Sveiki visiem! Meitenes, kas bija šādās situācijās, atbildēja! 27. maijā notika pirmā skrīnings. Ultraskaņa bija normāla. Viņi ierakstīja tālruni tikai gadījumā, bet es negaidīju, ka viņi varētu piezvanīt atpakaļ, un tagad nedēļā zvanu - atgriezties CPS, jums ir liels risks. Es neatceros sevi, asarās, es saņēmu kokvilnas kājas, es paņēmu visus papīra gabalus. Risks 1:53. Nākamajā dienā es devos uz dubultu. Ultraskaņa skatījās uz vēderu uz ļoti ilgu laiku, un magnāli, viņš vairākas reizes iekļāva Dopleru, un viss, šķiet, ir kaut kas, bet nepatika truskupidālā vārsta doplerometrija: regurgitācija. Ievadīja jaunās ultraskaņas datus programmā un iknedēļas ierobežojumu rezultātu pārbaudes, dators izdeva SD 1: 6 risku. Nosūtīts uz ģenētiku. Aplūkojot secinājumu, viņa man paskaidroja, ka šī regurgitācija varētu būt tikai augļa iezīme, bet par maksu ar nepietiekamu indikatoru Papp-A - 0,232 mamma ir hromosomu anomāliju marķieris. Viss pārējais normālā diapazonā. Viņi ieteica šķērsot biopsijas vorsīna koriju. Es joprojām atteicos, medmāsa gandrīz krita no krēsla, piemēram, risks ir tik augsts, un ha netiek ārstēti, un manā vietā viņa pat nedomās par minūti. Interesē ģenētika par panorāmas analīzi (briesmīgi dārgais gēns. Analīze par mātes asinīm), viņa atbildēja man, ka tas noteikti varētu tikt darīts, bet viņš neietver tikai 5 galveno ha un vairākus ļoti reti, viņš nevarēja pilnībā izslēgt anomālijas, Un manā gadījumā ir ieteicams iebrukums. Es jau izlasīju ton rakstu, jautājumus un visu, piemēram, šo tēmu, un es nesaprotu, kas ir tik briesmīgi atrodams manā analīzē? Regurgitācija, kā tas izrādījās fizioloģisks šajā periodā, un tas notiek līdz 18-20 nedēļām (ja tas nerunā par sirds defektu risku, daudzas nodziest pēc dzemdībām, un daži cilvēki dzīvo kopā ar to un neko neietekmē. It īpaši Viņas vīrs ilga mirstīgā vārsta, kas ieguva no mammas, varbūt tas ir kaut kā savstarpēji savienots). Hormoni var nebūt indikatīvi vispār, jo Es esmu pieņēmis Duphaston kopš grūtniecības sākuma, es drone 2 stundas pirms analīzes (izrādās, jūs nevarat ēst 4 stundas pirms, es to nedarīju), es dzēra kafiju, nervu un uztraucas par ultraskaņu Un asinis baidās, un nesen hronisks nogurums, ar vecāku bērnu es noguris. Un tas viss ietekmē rezultātus. Nekas tāpat kā ģenētikas netika jautāts, es neesmu ieinteresēts, viņiem ir kāda veida konveijera tur, un es, šķiet, ir shoved tur statistiku. Bet vienīgā šaubu viņi stādīja mani, es braucu, es uztraucos par gadu uz priekšu. Vīrs pārliecina biopsiju. Es esmu briesmīgi baidās no sekām, es baidos zaudēt vai kaitēt bērnam, it īpaši, ja viņš ir veselīgs. No vienas puses, ja viss ir labi, nopūta ar atvieglojumu un nosūtīt visus ārstus prom. No otras puses, ja viss ir slikts, ko darīt? Vai es varētu pārtraukt grūtniecību, ļaujiet bērnam manī, īpaši tagad, kad man šķiet, es sāku sajust to. Bet vēl viena iespēja varēs paaugstināt šādu bērnu, kam nepieciešama īpaša pieeja un liela uzmanība, kad reizēm vēlas aizbēgt no diezgan veselīgas meitas ... nopelt, visas šīs domas mani sūtīja. Es nezinu, kā būt ... tikai gadījumā es sniegšu skrīninga datus:
B-
Sirdsdarbības ātrums 161 ICE / min
Venozo kanālu pi 1,160
Korions / stādītājs zems uz priekšējās sienas
Pupovina 3 kuģi
Augļa anatomija: viss ir noteikts, viss ir normāls
b-HGCH 1,091 mamma
Papp-a 0.232 mamma
Dzemdes artērijas pi 1,240 mamma
Trisomija 21 1: 6
Trisomija 18 1: 311
Trisomija 13 1: 205
Preeclampsia līdz 34 nedēļām 1: 529
Preeclampsia līdz 37 nedēļām 1: 524
7.1. Diabēta klasifikācija
Diabēts(SD) ir vielmaiņas slimību grupa, ko raksturo hiperglikēmija sakarā ar insulīna sekrēcijas un / vai efektivitātes pārkāpumu. Hroniska hiperglikēmija, kas attīstās SD, ir pievienots daudzu orgānu un sistēmu komplikāciju izstrāde, pirmkārt, no sirds, asinsvadiem, acīm, nierēm un nerviem. Kopumā cieš no 5-6% iedzīvotāju. Ekonomiski attīstītajās pasaules valstīs ik pēc 10-15 gadiem pacientu skaits ar CD palielinās par 2 reizēm. Dzīves ilgums CD tiek samazināta par 10-15%.
SD attīstības cēloņi ir plaši mainīgi. Lielākajā daļā CD lietu, vai nu absolūtā insulīna deficīta dēļ (1. tipa cukura diabēts -SD-1) vai sakarā ar perifēro audu jutīguma samazināšanos insulīnam kombinācijā ar aizkuņģa dziedzera β-šūnu slepeno disfunkciju (2. tipa cukura diabēts -SD-2). Dažos gadījumos pacienta piešķiršana SD-1 vai SD-2 ir grūti, tomēr CD kompensācija ir nozīmīgāka, nevis precīza tās tipa izveide. Etioloģiskā klasifikācija piešķir četras galvenās SD klīniskās klases (7.1. Tabula).
Visbiežāk SD-1 (7.5. Punkts), SD-2 (7.6. Punkts) un gestācijas SD (7.9. Punkts) ir aplūkoti atsevišķās nodaļās. Uz citi konkrēti veidiir tikai aptuveni 1% gadījumu SD. Šādu SD tipu etioloģija un patogenēze ir vairāk pētīta, salīdzinot ar SD-1 un jo īpaši SD-2. Vairāki SD varianti ir saistīts ar monogēnu mantojumu funkcijas ģenētiskie defektiβ Pudeles.Tas ietver dažādas iespējas autosomālajam dominējošajam Mody sindromam (angļu valodā. termiņš ir jauniešu diabēts- pieaugušo diabēts jauniešiem), ko raksturo pārkāpums, bet ne insulīna sekrēcijas trūkums ar normālu jutību pret to perifēro audiem.
Tabula. 7.1.Diabēta klasifikācija
Radiāli reti atrasts insulīna ģenētiskie defektisavienots insulīna receptoru mutācija (leprechaunisms, plaukts mandehell sindroms). Cd dabiski attīstās ar aizkuņģa dziedzera eksocryan daļas slimības, \\ tved uz β-šūnu iznīcināšanu (pankreatītu, pancoratektomiju, cistisko fibrozi, hemohromatozi), kā arī ar vairākām endokrīnās slimībām, kurās notiek pārmērīgi nepārtrauktības hormonu produkti (akromegālija, cushing sindroms). Zāles un ķimikālijas(Vakor, pentamidīns, nikotīnskābe, diazoksīds utt.) Ir reti SD cēlonis, bet var veicināt slimības demonstrēšanu un dekompensāciju personām ar insulīna rezistenci. Rinda infekcijas slimības(Masalas, citomegālija, cokes un adenovīrusu infekcija) var pavadīt β šūnu iznīcināšanu, bet lielākā daļa pacientu nosaka imunogenētisko marķierus SD-1. Uz reti sastopami imūnmetrāžas diabēta formassD, attīstoties pacientiem ar "stīvu-rnan" -Sindrome (autoimūnu neiroloģisko slimību), kā arī diabētu, kas radušās autoantibu iedarbības uz insulīna receptoriem. Ir atrodami dažādi SD varianti ar paaugstinātu biežumu
daudzi ģenētiskie sindromi, jo īpaši uz leju sindromiem, Klinfelteru, Turner, volframa, Prader-Willie un vairākiem citiem.
7.2. Klīniskie aspekti ogļhidrātu metabolisma
Insulīnstā tiek sintezēta un izdalās ar aizkuņģa dziedzera salu salām (PJZ) salām. Turklāt Langerhans salas izdala glikagonu (α-šūnas), somatostatīnu (Δ šūnas) un aizkuņģa dziedzera polipeptīdu (PP šūnu). Hormoni saliņu šūnu mijiedarbojas viens ar otru: glikagons parasti stimulē insulīna sekrēciju, un somatostatīns nomāc insulīna un glikagona sekrēciju. Insulīna molekula sastāv no divām polipeptīdu ķēdēm (A-ķēde - 21 aminoskābe; ķēdes - 30 aminoskābes) (7.1. Att.). Insulīna sintēze sākas ar preproinsulīna veidošanos, kas sadala proteāzi izglītībai proinsulin.In sekretāra granulas mašīnas, Golgi, pinsulīna sadalīt insulīnu un C-peptīds, \\ tkas tiek izlaists asinīs eksocitozes procesā (7.2. Att.).
Galvenais insulīna sekrēcijas stimulators ir glikoze. Insulīna atbrīvošana, reaģējot uz glikozes līmeni asinīs divfāzs(7.3. Att.). Pirmais vai akūts fāze ilgst dažas minūtes, un tas ir saistīts ar uzkrāšanas izlaišanu
 Fig. 7.1.Insulīna molekulas primārās struktūras diagramma
Fig. 7.1.Insulīna molekulas primārās struktūras diagramma
 Fig. 7.2.Insulīna biosintēzes shēma
Fig. 7.2.Insulīna biosintēzes shēma
shegne ar β-šūnu insulīnu laika posmā starp ēdienreizēm. Otrais posms turpinās līdz glycēmijas līmenim sasniedz normālu tirgotāju (3,3-5,5 mmol / l). Tāpat β-šūnas ietekmē sulfonilurīnvielas preparātus.
Saskaņā ar portāla insulīna sistēmu sasniedz aknas- tā galvenais mērķa orgāns. Aknu receptoriem saistās pusi no izdalītā hormona. Vēl puse, kas iekrīt sistēmiskā asinsritē, sasniedz muskuļus un taukaudus. Lielākā daļa insulīna (80%) tiek pakļauts proteolītiskai sabrukumam aknās, pārējais ir nierēs, un tikai neliela summa tiek metabolizēta tieši ar muskuļu un tauku šūnām. Norma PJZ.
 Fig. 7.3.Divfāzes insulīna izlaišana glikozes ietekmē
Fig. 7.3.Divfāzes insulīna izlaišana glikozes ietekmē
pieaugušo vīrietis izdala 35-50 vienības dienā, kas ir 0,6-1,2 vienības uz 1 kg ķermeņa svara. Šis sekrēcija ir sadalīta uztura un bazālajā. Pārtikas sekrēcijainsulīna co konsultē poolprandial celšanas līmeni glikozes, t.e. Sakarā ar to tiek nodrošināta hipergikimizācijas pārtikas neitralizācija. Pārtikas insulīna daudzums aptuveni atbilst ogļhidrātu skaitam - apmēram 1-2,5
par 10-12 g ogļhidrātu (1 maizes vienība - hee). Bazālais sekrēcijas insulīnsnodrošina optimālu glycēmijas un anabolisma līmeni intervālos starp pārtiku un miega laikā. Bazālais insulīns tiek izdalīts apmēram 1 ANO / H ātrumā ar ilgtermiņa vingrinājumu vai ilgu badu, tas ievērojami samazinās. Pārtikas insulīns veido vismaz 50-70% no ikdienas insulīna ražošanas (7.4. Att.).
Insulīna sekrēcija ir pakļauta ne tikai pārtikai, bet arī ikdienas
 Fig. 7. .4.
Ikdienas ražošanas insulīna NORMA
Fig. 7. .4.
Ikdienas ražošanas insulīna NORMA
oscilācijas:nepieciešamība pēc insulīna paceļas agri no rīta, un nākotnē pakāpeniski samazinās dienas laikā. Tādējādi, 2,0-2,5 čības izdalās brokastīs uz 1 EB, pusdienām - 1,0-1,5 vienības, un vakariņām - 1,0 vienībām. Viens no iemesliem, kādēļ šādas izmaiņas insulīna jutība ir augsta līmeņa vairāku konkursu hormonu (galvenokārt kortizola) no rīta stundās, kas pakāpeniski samazinās līdz minimumam sākumā nakts laikā.
Pamata fizioloģiskā ietekme Insulinir stimulēšana glikozes pārneses caur insulīna atkarīgām audu membrānām. Galvenās insulīna ķermeņi ir aknas, taukaudi un muskuļi. Ar insulīna atkarīgajiem audiem, glikozes plūsma, kas nav atkarīga no insulīna ietekmes, galvenokārt ietver centrālo un perifēro nervu sistēmu, asinsvadu endotēlija, asinsvadu endotēlijs, asinsvadu utt. Insulīns stimulē glikogēna sintēzi aknās un muskuļi, tauku sintēze aknu un taukaudos, sintēzes proteīni aknās, muskuļos un citos orgānos. Visas šīs izmaiņas ir vērstas uz glikozes izmantošanu, kas noved pie tā līmeņa samazināšanās asinīs. Fizioloģiskā insulīna antagonists ir glikagonskas stimulē glikogēna un tauku mobilizāciju no depo; Parasti glikagona līmenis maina savstarpējos insulīna produktus.
Insulīna bioloģiskā iedarbība ir starpniecību receptorikas atrodas uz mērķa šūnām. Insulīna receptors ir glikoproteīns, kas sastāv no četriem apakšvienībām. Ar augstu insulīna līmeni asinīs ir samazināts tās receptoru skaits uz apakšējā regulējuma principa, kam pievieno šūnu jutības samazināšanos pret insulīnu. Pēc iesiešanas insulīna ar šūnu receptoru komplekss nāk šūnā. Tālāk muskuļu un tauku šūnas iekšpusē insulīns izraisa intracelulāro vezikulu mobilizāciju, kas satur glikozes konveijersGlut-4. Tā rezultātā, vezikulas pāriet uz šūnu virsmu, kur glut-4 veic funkciju ieplūdes glikozes. Līdzīga ietekme uz glut-4 ir fiziska piepūle.
7.3. Laboratorijas diagnostika un diabēta kompensācijas kritēriji
SD laboratorijas diagnostika ir balstīta uz glikozes līmeņa noteikšanu, bet diagnostikas kritēriji ir vienoti visiem
veidi un varianti SD (7.2 tabula). Pārējo laboratorijas pētījumu dati (glikozūrijas līmenis, glilētā hemoglobīna līmeņa definīcija) nedrīkst izmantot, lai pārbaudītu diagnozes diagnozi. SD diagnozi var noteikt, pamatojoties uz divu laika noteikšanu vienā no trīs kritēriji:
1. Ar acīmredzamiem SD simptomiem (poliuria, polydipsi) un glikozes līmenis cietā kapilārā asinīs, vairāk nekā 11.1 mmol / l neatkarīgi no dienas un pirms ēdienreizēm.
2. Glikozes līmenī cietā kapilārā asinīs tukšs kuņģis ir vairāk nekā 6,1 mmol / l.
3. Līmenī glikozes cietā kapilāru asins 2 stundas pēc saņemšanas 75 gramiem glikozes (mutes glikozes gultņu) vairāk nekā 11.1 mmol / l.
Tabula. 7.2.Kritēriji diabēta diagnosticēšanai
 Vissvarīgākais un nozīmīgākais tests CD diagnostikā ir noteikt glycēmijas līmeni tukšā dūšā (vismaz 8 stundas badošanās). Krievijas Federācijā glycēmijas līmenis parasti tiek lēsts cietā asinīs. Daudzas valstis tiek plaši izmantotas, lai noteiktu glikozes līmeni
Vissvarīgākais un nozīmīgākais tests CD diagnostikā ir noteikt glycēmijas līmeni tukšā dūšā (vismaz 8 stundas badošanās). Krievijas Federācijā glycēmijas līmenis parasti tiek lēsts cietā asinīs. Daudzas valstis tiek plaši izmantotas, lai noteiktu glikozes līmeni
asins plazmā. Mutisks glikozes bārdains tests(Ogtt; Noteikšana līmeņa glikozes 2 stundas pēc ievadīšanas iekšpusē 75 gramus glikozes izšķīdušā ūdenī) šajā sakarā ir mazāka vērtība. Tomēr, pamatojoties uz Ogtt, tiek diagnosticēts glikozes tolerances pārkāpums(NTG). NTH diagnosticē, ja cietā kapilārā asins glikēmijas līmenis nav pārsniegts 6,1 mmol / l, un 2 stundas pēc slodzes, glikoze ir augstāka par 7,8 mmol / l, bet zem 11.1 mmol / l. Vēl viens ogļhidrātu apmaiņas iemiesojums ir pārkāpis glikēmiju tukšā veikalā(NGN). Pēdējais ir izveidots, ja cietā kapilāro asins glicēmijas līmenis ir tukšā dūšā no 5,6-6,0 mmol / l, un 2 stundas pēc slodzes ar glikozi, kas ir mazāks par 7,8 mmol / l). NTG un NGNT pašlaik apvieno terminu postiabettā kā abas pacientu kategorijas ir ļoti augsts SD izpausmes risks un diabēta makroangiopātijas attīstība.
Lai diagnosticētu SD, glycēmijas līmenis jānosaka ar standarta laboratorijas metodēm. Glikēmijas rādītāju interpretācijā jāpatur prātā, ka tukšs kuņģa glikozes līmenis cietā venozā asinīs atbilst tās līmenim cietā kapilārā. Pēc pārtikas vai OGTT saņemšanas tās līmenis venozā asinīs ir aptuveni 1,1 mmol / l zemāks nekā kapilārā. Glikozes saturs plazmā ir aptuveni 0,84 mmol / l augstāks nekā cietā asinīs. Lai novērtētu kompensāciju un atbilstību CD terapijas, glycēmijas līmenis ir aprēķināts kapilāru asinīs, izmantojot pārnēsājamo glikometrspaši pacienti, viņu radinieki vai medicīnas personāls.
Ar jebkāda veida diabētu, kā arī ar ievērojamu slodzi glikozes var attīstīties glikosūrijakas ir sekas, kas pārsniedz glikozes reabsorbcijas slieksni no primārā urīna. Glikozes reabsorbcijas slieksnis būtiski atšķiras (≈ 9-10 mmol / l). Tā kā atsevišķs glikozūrijas indikators nedrīkst izmantot SD diagnozi. Parasti, izņemot gadījumus, kad ir nozīmīgas pārtikas slodzes rafinēti ogļhidrāti, glikozūrija nav atrasts.
Produkti ketone tel(Acetons, acetoacetāts, beta-hidroksibutirāts) ir būtiski pastiprināta absolūtā insulīna deficīta dēļ. Ja dekompensācija, SD-1 var definēt izteiktu ketonūrija(Pēta testa sloksnes, kas ir pazeminātas urīnā). Easy (Trace) Ketonūrija var noteikt veseliem cilvēkiem ar badu un fermentētu diētu.
Svarīgs laboratorijas rādītājs, ko izmanto SD tipu diferenciālajai diagnostikai, kā arī identificēt insulīna deficīta veidošanos pacientiem ar SD-2, ir līmenis C-peptīds.Runājot par C-peptīda līmeni asinīs, ir neapstrīdams spriest par PJZ β-šūnu ievietošanas spēju. Pēdējais ražotājs Proinsulin, no kura C-peptīds ir šķelts pirms sekrēcijas, kas ietilpst asinīs tādā pašā apjomā ar insulīnu. Insulīns ir 50% sazinājās aknās, un ir pusperiods perifēro asinīs apmēram 4 minūtes. C-peptīds no asins plūsmas aknām nav noņemts un ir pusperiods asinīs apmēram 30 minūtes. Turklāt tas nav saistīts ar šūnu receptoriem perifērijā. Tāpēc C-peptīda līmeņa definīcija ir ticamāks tests, lai novērtētu sadales iekārtas funkciju. C-peptīda līmenis ir visizglītots, ņemot vērā stimulācijas paraugus (pēc glikagona ēšanas vai ievadīšanas). Tests nav informatīvs, ja tas tiek veikts, ņemot vērā izteiktu dekompensāciju SD, jo izteiktajai hiperglikēmijai ir toksiska iedarbība uz β-šūnām (glikozotoksicitāti). Insulīna terapija vairākām iepriekšējām dienām testa rezultātiem neietekmēs.
Galvenais Ārstēšanas mērķisjebkura veida CD ir novērst tās novēlotās komplikācijas, kuras var sasniegt, ņemot vērā tā stabilu kompensāciju par vairākiem parametriem (7.3. Tabula). Galvenais ogļhidrātu metabolisma kompensācijas kvalitātes kritērijs zem CD ir līmenis gladzēts (glikozilēts) hemoglobīns (HBA1C).Pēdējais ir hemoglobīns, kas nav saistīts ar glikozi. Glikozes eritrocītos neatkarīgi no insulīna, un hemoglobīna glicozilēšana ir neatgriezenisks process, un tās pakāpe ir tieši proporcionāla glikozes koncentrācijai, ar kuru tā ir sazinājusies ar 120 dienām pēc tās pastāvēšanas. Neliela daļa hemoglobīna ir glikozilēta un normāla; Ar CD to var ievērojami palielināt. HBA1C līmenis, atšķirībā no glikozes līmeņa, kas pastāvīgi mainās, pilnībā atspoguļo glikēmiju pēdējo 3-4 mēnešu laikā. Tas ir ar šo intervālu, ka HBA1C līmenis ir ieteicams novērtēt kompensāciju SD.
Hronisks hiperglikēmija ir tālu no vienīgā riska faktora SD novēlotu komplikāciju izstrādei un progresēšanai. Par kompensācijas novērtējums SDpamatojoties uz kompleksu
laboratorijas un instrumentālās pētniecības metodes (7.3. Tabula). Papildus rādītājiem, kas raksturo ogļhidrātu vielmaiņas stāvokli, vissvarīgākais ir asinsspiediena līmenis un lipīdu spektrs asinīs.
Tabula. 7.3.Cukura diabēta kompensācijas kritēriji
 Papildus iepriekš minētajiem kompensācijas kritērijiem ir nepieciešama individuāla pieeja, plānojot CD apstrādes mērķus. SD (īpaši mikroangiopātijas) novēloto komplikāciju attīstības varbūtība palielinās, palielinoties slimības ilgumam. Tādējādi, ja bērniem un jauniem pacientiem diabēta ilgums nākotnē var sasniegt vairākus gadu desmitus, tas ir nepieciešams, lai sasniegtu optimālus glikēmijas rādītājus, tad pacientiem, kuriem ir CD izpausme vecāka gadagājuma un vecuma, stingra eugleCemic kompensācija, būtiski hipoglikēmijas riska uzlabošana ne vienmēr ir piemērota.
Papildus iepriekš minētajiem kompensācijas kritērijiem ir nepieciešama individuāla pieeja, plānojot CD apstrādes mērķus. SD (īpaši mikroangiopātijas) novēloto komplikāciju attīstības varbūtība palielinās, palielinoties slimības ilgumam. Tādējādi, ja bērniem un jauniem pacientiem diabēta ilgums nākotnē var sasniegt vairākus gadu desmitus, tas ir nepieciešams, lai sasniegtu optimālus glikēmijas rādītājus, tad pacientiem, kuriem ir CD izpausme vecāka gadagājuma un vecuma, stingra eugleCemic kompensācija, būtiski hipoglikēmijas riska uzlabošana ne vienmēr ir piemērota.
7.4. Insulīna un insulīna terapijas preparāti
Insulīna preparāti ir būtiski pacientiem ar SD-1; Turklāt viņi saņem līdz 40% pacientu ar SD-2. Kopīgs norādes par insulīna terapijas iecelšanu SD, \\ tdaudzi no tiem faktiski pārklājas viens cits ietver:
1. 1. tipa cukura diabēts
2. Panketektomija
3. Ketoacidotisks un hiperosmolārais koma
4. Ar diabētu Mellitus 2. tipa:
Skaidras insulīna deficīta pazīmes, piemēram, ķermeņa svara un ketozes pakāpe, izteikta hiperglikēmija;
Lielas ķirurģiskas iejaukšanās;
Akūtas makro-sarežģītas komplikācijas (insults, miokarda infarkts, gangrēna, uc) un smagas infekcijas slimības, ko papildina ogļhidrātu metabolisma dekompensācija;
Glikēmijas līmenis ir tukšs kuņģis vairāk nekā 15-18 mmol / l;
Kompensācijas maksāšanas trūkums, neraugoties uz dažādu tablešu saharincing narkotiku maksimālās dienas devām;
SD (smaga polineuropātijas un retinopātijas, hroniskas nieru mazspējas vēlu komplikāciju vēlu komplikāciju beigās vēlu posmi).
5. Nespēja kompensēt gestācijas diabētu, izmantojot diētu un terapiju.
Pēc izcelsmesinsulīna preparātus var klasificēt trīs grupās:
Dzīvnieki insulīni (cūkgaļa);
Cilvēka insulīni (daļēji sintētiska, ģenētiskā inženierija);
Analogi insulīnu (LizPro, asparts, Glargin, Demide).
Cilvēka insulīnu ražošanas tehnoloģiju attīstība noveda pie izmantošanas cūkgaļas insulīns(Atšķirībā no cilvēka aminoskābes) nesen ir ievērojami samazinājies. Cūkgaļas insulīnu var izmantot cilvēka insulīna ražošanai daļēji sintētiska metodekas nozīmē viena cita aminoskābju nomaiņu savā molekulā. Augstākā kvalitāte ir atšķirīga Ģenētiski inženierijacilvēku insulīni. Lai iegūtu tos, cilvēka genoma vietne, kas atbild par insulīna sintēzi ir saistīta ar genomu E.coli.vai rauga kultūra, kura rezultātā tā sāk ražot cilvēka insulīnu. Radījums analogs insulīnsar dažādu aminoskābju permutāciju palīdzību tika īstenota narkotiku iegūšanas mērķis ar konkrēto un visizdevīgāko farmakokinētiku. Tātad, insulīns LizPro (humalog) ir analogs
ultrashort darbības insulīns, bet tā sacharincing efekts attīstās pēc 15 minūtēm pēc injekcijas. Glargin insulīna (Lantus) analogs, gluži pretēji, ir raksturīgs ilgtermiņa darbībai, kas turpinās visu dienu, savukārt narkotiku kinētikas iezīme ir izrunāto plazmas koncentrācijas virsotņu trūkums. Lielākā daļa no pašlaik izmantotajiem insulīna preparātiem un tā analogiem tiek ražoti koncentrācija100 U / ml. Ar darbības ilgumsiNSULINES ir sadalītas 4 galvenajās grupās (7.4. Tabula):
Tabula. 7.4.Narkotiku un insulīna analogu farmakokinētika
 1.
Ultrashort darbība (Lizpro, asparts).
1.
Ultrashort darbība (Lizpro, asparts).
2. Īss rīcība (vienkāršs cilvēka insulīns).
3. Vidējais darbības ilgums (insulīni neitrālā protamīna hagēnajā).
4. Ilgtermiņa darbība (Glagragin, Detech).
5. Dažādu darbības ilguma insulīnu maisījumi (NovoMix-30, Humulin-MH, Humalog Mix-25).
Preparāti ultrashort darbība[LizPro (Humalog), Aspart (NovoRad)] ir insulīna analogi. Viņu priekšrocības ir strauja cukura efekta ietekme pēc injekcijas (pēc 15 minūtēm), kas ļauj jums veikt injekciju tieši pirms ēšanas vai pat tūlīt pēc ēšanas, kā arī īsu darbības ilgumu (mazāk nekā 3 stundas) , kas samazina hipoglikēmijas risku. Preparāti Īss rīcība(Vienkāršs insulīns, insulīns regulārs) ir šķīdums, kas satur insulīnu pie koncentrācijas 100 vienības / ml. Vienkārša insulīna injekcija tiek veikta 30 minūtes pirms ēšanas; Darbības ilgums ir aptuveni 4-6 stundas. Ultra-skrūves un īsu darbības preparātus var ievadīt subkutāni, intramuskulāri un intravenozi.
Starp narkotikām vidējais darbības ilgumsvisbiežāk preparāti tiek izmantoti neitrālā protamīna hagedorn (NPH). NPH ir proteīns, kas nav zināms adsorb insulīns, palēninot savu sūkni no zemādas depo. NPH insulīna darbības efektīvais ilgums parasti ir aptuveni 12 stundas; Tie tiek ievadīti tikai subkutāni. Insulin NPH ir suspensija, kas saistībā ar kuru, atšķirībā no vienkārša insulīna flakonā, tas ir dubļains, un ar ilgu stāv ir suspensija, kas ir rūpīgi jauktas pirms injekcijas. NPH insulīni Atšķirībā no citiem ilgstošas \u200b\u200bdarbības preparātiem var sajaukt ar īslaicīgu iedarbināšanu insulīnu (vienkāršs insulīns), bet maisījuma komponentu farmakokinētika nemainīsies, jo NPH nepiesaisīs papildu vienkāršā insulīna daudzumu (7.5. Att.). Turklāt protamīns tiek izmantots, lai sagatavotu standarta maisījumus insulīna analogiem (NovoMix-30, Humalog-Mix-25).
Starp narkotikām ilgtermiņa rīcību pašlaik aktīvi izmanto analogus insulīna glaržīns(Lantus) un atturīgs(Leewemir). Šīs narkotiku farmakokinētikas labvēlīgā iezīme ir tā, ka pretēji NPC insulīniem tie nodrošina vienveidīgāku un ilgstošu narkotiku plūsmu no subkutānas depo. Šajā sakarā Glargin var iecelt tikai vienu reizi dienā, bet gandrīz nav laika neatkarīgi no dienas dienas.
 Fig. 7.5.Farmakokkaletika dažādu insulīna preparātu:
Fig. 7.5.Farmakokkaletika dažādu insulīna preparātu:
a) monokompents; b) standarta insulīna maisījumi
Papildus monocomponent narkotiku insulīnu, klīniskā prakse tiek plaši izmantota standarta maisījumi.Kā likums, mēs runājam par īsu vai ultrashort insulīna maisījumiem ar vidējo darbības ilgumu insulīnu. Piemēram, narkotiku "Humulin-MW" satur vienu pudeli 30% no vienkārša insulīna un 70% insulīna NPH; Zāles "Novomiks-30" satur 30% asparta insulīna un 70% no kristāla protamīna pārtraukšanas asparta; Zāles "Humalog-Mix-25" satur 25% insulīna Lyspro un 75% Prothnce insulīna līzinga apturēšana. Priekšrocība
standarta insulīna maisījumi ir nomaiņa divu injekciju viena un vairākas lielas precizitātes maisījuma sastāvdaļu; Trūkums ir neiespējamība individuālo dozēšanas atsevišķu sastāvdaļu maisījuma. Tas nosaka priekšroku standarta insulīna maisījumu izmantošanai CD-2 terapijai vai tā sauktajam tradicionālā insulīna terapija(fiksēto insulīnu devu iecelšana), bet par intensīva insulīna terapija(Elastīga devu izvēle atkarībā no glikēmijas rādītājiem un ogļhidrātu daudzumu pārtikā) ir vēlams izmantot monokomponentu narkotiku lietošanu.
Veiksmīgas insulīna terapijas atslēga ir skaidrs ievērošana injekcijas metodes.Ir vairāki veidi, kā ieviest insulīnu. Vieglākais un vienkāršākais no uzticamās metodes - injekcijas ar insulīnu Šļirce.Ērtāks veids, kā ieviest insulīnu, ir injekcijas, izmantojot šļirču pogaskas ir apvienota ierīce, kas satur insulīna tvertni (kasetni), dozēšanas sistēmu un inžektora adatu.
Lai atbalstītu terapiju (kad runa ir par izteiktu SD dekompensāciju vai kritiskām valstīm), insulīns tiek ieviests subkutāni. Ieteicams veikt īsās darbības insulīna insulīna insulīna subkutāni tauku audos, ilgstošas \u200b\u200bdarbības insulīns - gūžas vai pleca šķiedrvielu (7.6. Att.). Injekcijas tiek veidotas dziļi zemādas audos, izmantojot plaši saspiestu ādu 45 ° leņķī (7.6. Att. B). Pacientam ir nepieciešams ieteikt ikdienas insulīna injekcijas vietu maiņu tajā pašā zonā, lai novērstu lipodistrofu attīstību.
Uz faktori, kas ietekmē insulīna absorbcijas ātrumuno subkutānas Depot insulīna deva ir jāpiešķir (devas palielinājums palielina absorbcijas ilgumu), injekcijas vietā (absorbcija ir ātrāka no vēdera šķiedras), apkārtējās vides temperatūra (apkure un masāža injekcijas vietā paātrina absorbciju ).
Sarežģītāka lietošanas metode, kas, tomēr daudzos pacientiem ļauj sasniegt labus ārstēšanas rezultātus, ir izmantot insulīna dozatorsvai sistēmas nepārtrauktai subkutānai insulīna ievadīšanai. Dispenser ir pārnēsājama ierīce, kas sastāv no datora, kas nosaka insulīna padeves režīmu, kā arī insulīna padeves sistēmu, kas tiek veikta uz katetra un miniatūras adatu subkutānai
 Fig. 7.6.Injekcijas injekcijas: a) tipiskas injekcijas vietas; b) injekcijas laikā insulīna šļirces adatas stāvoklis
Fig. 7.6.Injekcijas injekcijas: a) tipiskas injekcijas vietas; b) injekcijas laikā insulīna šļirces adatas stāvoklis
tauku audi. Ar izsmidzinātāja palīdzību tiek veikta nepārtraukta īsa vai ultrashorta insulīna izzuālā ieviešana (apmēram 0,5-1 E / stundā), un pirms pārtikas lietošanas atkarībā no ogļhidrātu satura un glicēmijas līmenis, \\ t Pacients ievieš nepieciešamo bolus devu tāda paša insulīna īsu rīcību. Insulīna terapijas priekšrocība ar izsmidzinātāja palīdzību ir īsa (vai pat ultrashorta) insulīna ieviešana, kas pati par sevi ir nedaudz vairāk fizioloģiski, jo ilgstošu insulīna preparātu uzsūkšanās ir pakļauta lielām svārstībām; Šajā sakarā īsās darbības insulīna nepārtraukta ieviešana izrādās vadāms process. Insulīna terapijas trūkums ar izsmidzinātāja palīdzību ir nepieciešama konstanta nesēju, kā arī injekcijas adatas ilgtermiņa dibināšana zemādas audos, kas prasa periodisku kontroli pār insulīna piegādes procesu. Insulīna terapija ar dozatora palīdzību galvenokārt ir pierādīts pacientiem ar SD-1, kas ir gatavi apgūt tās uzturēšanas tehniku. Īpaši šajā sakarā, jums jāpievērš uzmanība pacientiem ar izteiktu parādību "rīta rītausmā", kā arī grūtniecēm un plāno grūtniecību pacientiem ar SD-1 un Parīzi
ar nesakārtotu dzīvesveidu (iespēja elastīgāku jaudas režīmu).
7.5. 1. tipa cukura diabēts
SD-1 - specifisks oriģināls autoimūnsslimība, kas noved pie PJZ saliņu insulīna ražošanas β-šūnu iznīcināšanas, kas izpaužas absolūtā insulīna deficīta dēļ. Dažos gadījumos pacientiem ar skaidru SD-1 trūkst autoimūnu bojājumu marķieriem no β-šūnām (idiopātisks SD-1).
Etioloģija
SD-1 ir slimība ar iedzimtu predispozīciju, bet tās ieguldījums slimības attīstībā ir neliela (nosaka tās attīstību par aptuveni 1 / s). Vienas personas dvīņu ekstrards SD-1 ir tikai 36%. SD-1 attīstības varbūtība bērnam ar slimu māti ir 1-2%, tēvs - 3-6%, brālis vai māsa - 6%. Daži vai daži humorālie marķieri autoimūnu bojājumiem, uz kurām antivielas ietver antivielas uz PJZ, antivielas līdz glutamāta dekarboksilāzes (GAD65) un antivielas līdz tirozīna fosfatāzei (IA-2 un ια-2β) ir atrodami 85-90% pacientiem. Tomēr šūnu imunitātes faktori ir pievienoti β šūnu iznīcināšanai. SD-1 ir saistīts ar HLA haplotipiem, piemēram, DQA.un DQB,tajā pašā laikā vien alele Hla-dr / dqvar būt nosliece uz attīstību slimības, bet citi ir protesti. Ar palielinātu SD-1 biežumu kopā ar citiem autoimūniem endokrinētiem (autoimūna vairogdziedzera, addison slimības) un ne-alkohola slimībām, piemēram, alopēciju, vitiligo, kronis slimības, reimatisko slimību (7.5 tabula).
Patogenēze
SD-1 izpaužas, iznīcinot autoimūnu procesu 80-90% β-šūnu laikā. Šī procesa ātrums un intensitāte var ievērojami atšķirties. Visbiežāk tipiska plūsmaslimības bērniem un jauniešiem Šis process turpinās diezgan ātri, kam seko vardarbīga izpausme slimības, kurā parādīšanās pirmos klīniskos simptomus attīstībai ketoacidosis (līdz ketoacidotic koma) var iziet tikai dažas nedēļas.
Tabula. 7.5.1. tipa cukura diabēts
 Tabulas turpināšana. 7.5.
Tabulas turpināšana. 7.5.
 Citiem, ievērojami vairāk retu gadījumu, kā likums pieaugušajiem vairāk nekā 40 gadus vecs, slimība var plūsmas latentā (Latento autoimūna diabēts pieaugušie - Lada),tajā pašā laikā slimības debijas šādiem pacientiem bieži izveido SD-2 diagnozi, un vairāku gadu gaitā CD kompensāciju var panākt, ieceļot sulfonilurīnvielas narkotikas. Bet nākotnē parasti 3 gadus vēlāk ir absolūtās insulīna deficīta pazīmes (svara zudums, ketonūrija, izteikta hiperglikēmija, neskatoties uz tableted saharincing narkotiku saņemšanu).
Citiem, ievērojami vairāk retu gadījumu, kā likums pieaugušajiem vairāk nekā 40 gadus vecs, slimība var plūsmas latentā (Latento autoimūna diabēts pieaugušie - Lada),tajā pašā laikā slimības debijas šādiem pacientiem bieži izveido SD-2 diagnozi, un vairāku gadu gaitā CD kompensāciju var panākt, ieceļot sulfonilurīnvielas narkotikas. Bet nākotnē parasti 3 gadus vēlāk ir absolūtās insulīna deficīta pazīmes (svara zudums, ketonūrija, izteikta hiperglikēmija, neskatoties uz tableted saharincing narkotiku saņemšanu).
Pamatojoties uz SD-1 patoģenēzi, kā norādīts, ir absolūtais insulīna deficīts. Neiespējamība ievadīt glikozi insulīna atkarīgos audumos (tauku un muskuļu) noved pie enerģijas mazspēja, kas izraisa pastiprinājumus lipolīzi un proteolīzi, ar kuru ir saistīta ķermeņa svara zudums. Glikēmijas līmeņa paaugstināšanās izraisa hiperosmītritumu, ko papildina osmotisko diurēze un izrunāta dehidratācija. Insulīna deficīta un enerģijas atteices apstākļos tiek izstrādāti konjunktūras hormonu izstrādājumi (glikagons, kortizols, augšanas hormons), kas, neskatoties uz glikēmijas pieaugošo, nosaka glukenesis stimulēšanu. Lipolīzes pieaugums taukaudos rada ievērojamu brīvo taukskābju koncentrācijas pieaugumu. Ar insulīna deficītu, aknu lipososnthetic spēja tiek nomākta, un
taukskābes sāk ieslēgt ketogenēzi. Ketona iestāžu uzkrāšanās izraisa diabēta ketozes attīstību un nākotnē - ketoacidosis. Ar pakāpenisku dehidratācijas un acidozes pieaugumu attīstās kompromisa stāvoklis (sk. 7.7.1. Punktu), kas, ja nav insulīna terapijas un rehidratācijas, neizbēgami beidzas ar nāvi.
Epidemioloģija
SD-1, ir aptuveni 1,5-2% no visiem diabēta gadījumiem, un šis relatīvais skaitlis turpinās samazināties, jo SD-2 sastopamība straujš pieaugums. SD-1 attīstības risks visā Baltās sacensības pārstāvja dzīvē ir aptuveni 0,4%. SD-1 sastopamība palielinās par 3% gadā: par 1,5% jauniem gadījumiem un vēl 1,5% dēļ pacientu dzīves ilguma pieauguma dēļ. SD-1 izplatība atšķiras atkarībā no iedzīvotāju etniskās sastāva. 2000. gadā tas sasniedza 0,02% Āfrikā, 0,1% Dienvidāzijā, kā arī Dienvidos un Centrālamerikā un 0,2% Eiropā un Ziemeļamerikā. Vislielākais SD-1 sastopamība Somijā un Zviedrijā (30-35 gadījumi uz 100 tūkstošiem iedzīvotāju gadā), un zemākais Japānā, Ķīnā un Korejā (attiecīgi 0,5-2,0 gadījumi). SD-1 izpausmes vecums atbilst apmēram 10-13 gadiem. Lielākajā daļā gadījumu SD-1 izpaužas līdz 40 gadiem.
Klīniskās izpausmes
Iebildums tipiski gadījumiĪpaši bērniem un jauniešiem SD-1 debijas spilgti klīnisko attēlu, kas attīstās vairākus mēnešus vai pat nedēļas. SD-1 izpausme var izraisīt infekcijas un citas vienlaicīgas slimības. Raksturīgs kopīgs visu veidu SD simptomiem, \\ tsaistīts ar hiperglikēmiju: polidipsi, poliūrija, ādas nieze, bet SD-1 tie ir ļoti izteikti. Tātad, visu dienu, pacienti var dzert un iegūt līdz 5-10 litriem šķidruma. SpecifiskssD-1, simptoms, kas ir saistīts ar absolūto trūkumu insulīna, ir svara zudums, sasniedzot 10-15 kg 1-2 mēnešiem. To raksturo smaga vispārēja un muskuļu vājums, samazināta veiktspēja, miegainība. Slimības sākumā daži pacienti var rasties apetītes pieaugums, ko aizstāj anoreksija kā ketoacidoze attīstās. Pēdējo raksturo acetona smaržas (vai augļu smaržas) izskats no mutes, Tosh
nesa, vemšana, bieži vien sāpes kuņģī (pseudoperitonīts), smaga dehidratācija un beidzas ar kompromisa stāvokļa attīstību (sk. 7.7.1. Punktu). Dažos gadījumos pirmais SD-1 izpausme bērniem ir progresīva sajūta apziņas līdz koma pret fonu vienlaikus slimību, kā likums, infekcijas vai akūtu ķirurģisko patoloģiju.
Salīdzinoši retos gadījumos attīstību SD-1 personām vairāk nekā 35-40 gadus (Latento autoimūna pieaugušo diabēts)slimība var būt acīmredzama ne tik spilgta (mērena polydipsija un poliūrija, ķermeņa svara zuduma trūkums) un pat atklāt nejauši ar ikdienas glicēmijas definīciju. Šādos gadījumos pacientam bieži ir noteikts SD-2 un tableeted sacerincarincveida preparātu (TSP) diagnoze (TSP), kas kādu laiku nodrošina pieņemamu CD kompensāciju. Tomēr vairākus gadus (bieži gada laikā) pacients šķiet simptomi, ko izraisa pieaugošais absolūtais insulīna deficīts: svara zudums, neiespējamība uzturēt normālu glikēmiju uz TAP, ketozes, ketoacidozes fona, ketozi, ketozi.
Diagnostika
Ņemot vērā, ka SD-1 ir spilgts klīniskais attēls, un tas ir arī salīdzinoši reta slimība, glikēmijas līmeņa skrīninga definīcija netiek parādīta SD-1 diagnosticēšanai. Slimības attīstības varbūtība pie tuvākajiem pacientu radiniekiem ir zems, kas kopā ar efektīvu primārās profilakses, SD-1 trūkumu nosaka imunoģenētisko slimību marķieru izpētes neizteikums. SD-1 diagnoze lielākā daļa ir balstīta uz nozīmīgas hiperglikēmijas identificēšanu pacientiem ar smagām insulīna trūkuma klīniskām izpausmēm. OGTT, lai diagnostikas SD-1 ir jāveic ļoti reti.
Diferenciāldiagnoze
Šaubīgiem gadījumiem (vidējas hiperglikēmijas atklāšana, ja nav skaidru klīnisko izpausmju, izpausmes relatīvi vecāka gadagājuma cilvēkiem), kā arī, lai noteiktu līmeni, tiek izmantots diferenciāldiagnostikas ar cita veida SD, tiek izmantots, lai noteiktu līmeni C-peptīds(Basal un 2 stundas pēc ēšanas). Netieša diagnostikas vērtība šaubīgajos gadījumos var būt definīcija imunoloģiskie marķieriSD-1 - antivielas mutē
PJZ, GLUTAMATDEKARBOXYLASE (GAD65) un tirozīna fosfatāze (IA-2 un IA-2β). SD-1 un SD-2 diferenciālā diagnoze ir parādīta tabulā. 7.6.
Tabula. 7.6.Diferenciāldiagnoze un atšķirības starp SD-1 un SD-2
 Ārstēšana
Ārstēšana
Jebkura veida CD ir balstīta uz trim pamatprincipiem: Sakharosyning terapija (ar SD-1 - insulīna terapiju), diētu un pacientu apmācību. InsulinoterapijasD-1 nēsā aizvietošanaun tā mērķis ir hormona fizioloģisko produktu maksimāla imitācija, lai sasniegtu pieņemtos kompensācijas kritērijus (7.3. Tabula). Uz insulīna fizioloģisko sekrēciju ir visvairāk aptuvenais intensīva insulīna terapija.Nepieciešamība pēc insulīna atbilstoši tam bazālo sekrēciju,to nodrošina divas insulīna injekcijas par vidējo darbības ilgumu (no rīta un vakarā) vai vienu ilgstošu insulīna injekciju (glargy). Kopējā bazālo inso-
lina nedrīkst pārsniegt pusi no visas ikdienas vajadzības pēc sagatavošanas. Pārtika vai bolus insulīna sekrēcijato aizstāj ar īsa vai ultrasortas darbības insulīna injulēšanu pirms katras ēdienreizes, bet tās deva tiek aprēķināta, pamatojoties uz ogļhidrātu daudzumu, kas ir paredzēts, lai tiktu pieņemts gaidāmajā pārtikas patēriņā, un esošajā līmenī Glikēmija, ko pacients nosaka ar glikometri pirms katras insulīna injekcijas (7.7. Att.).
Tuvs intensīva insulīna terapijas shēma, \\ tkas būs gandrīz katru dienu, var būt šādi. Viņi turpina no tā, ka ikdienas vajadzība pēc insulīna ir aptuveni 0,5-0,7 vienības uz 1 kg ķermeņa masas (pacientam ar ķermeņa masu 70 kg apmēram 35-50 vienības). Aptuveni 1 / s - 1/2 no šīs devas būs ilgstošas \u200b\u200bdarbības insulīns (20-25 vienības), 1/2 - 2 / s insulīns īsu vai ultrashort darbību. Insulīna NPH deva ir sadalīta 2 injekcijās: no rīta 2 / s devas (12 vienības) vakarā - 1 / s (8-10 vienības).
Mērķis pirmais posmsblīvēšanas insulīna terapija ir normalizācija līmeņa glikozes tukšā dūšā. Vakara deva insulīna NPH parasti tiek ieviesta 22-23 stundas, rīta kopā ar injekciju īsu darbības insulīnu priekšā brokastis. Izvēloties insulīna NPH vakara devu, ir jāpatur prātā iespēja izstrādāt numuru
 Fig. 7.7.Intensīvas insulīna terapijas shēma
Fig. 7.7.Intensīvas insulīna terapijas shēma
diezgan tipiskas parādības. No rīta hiperglikēmija var būt nepietiekama deva insulīna ilgstošas \u200b\u200bdarbības, jo no rīta nepieciešamība pēc insulīna ievērojami palielinās ("Rīta rīta" parādība).Papildus devas deficītu, tā pārpalikums var izraisīt rīta hiperglikēmiju. fenomens Somena(Somogyi), postgoglikēmiskā hiperglikēmija. Šo parādību izskaidro fakts, ka maksimālais audu jutīgums pret insulīnu ir atzīmēta no 2 līdz 4 stundām naktī. Šobrīd ir normāli, ir normāli, ka pamata CONSAULRAL hormonu (kortizola, augšanas hormona uc) līmenis ir normāls. Ja ilgstošas \u200b\u200bdarbības insulīna deva ir pārmērīga, tad šajā laikā attīstās hipoglikēmija.Klīniski tas var izpausties sliktu miegu ar murgu sapņiem, neapzinātu darbību sapnī, rīta galvassāpes un sadalījums. Attīstība šajā hipoglikēmijas laikā izraisa ievērojamu kompensācijas glikagona kompensācijas emisiju un citus konkursa hormonus hiperglikēmija rīta pulkstenī.Ja šajā situācijā, tas nav samazināts, bet, lai palielinātu devu ilgstošas \u200b\u200binsulīna, investē vakarā, nakts hipoglikēmija un rīta hiperglikēmija tiks saasināta, ka galu galā tas var novest pie hroniskas insulīna sindroma sindroma (Somoga sindroms) , Kas ir aptaukošanās kombinācija ar hronisku SD dekompensāciju, biežu hipoglikēmiju un progresīvām vēlu komplikācijām. Somoga parādības diagnostikai ir jāizpēta glicēmijas līmenis apmēram 3 stundas, kas ir insulīna terapijas atlases neatņemama sastāvdaļa. Ja naktī hipoglikēmijas samazināšanās ir pievienota naktī hipoglikēmijas attīstībai, ir pievienots hiperglikēmija no rīta (rīta rītausmas parādība), pacientam ir nepieciešams ieteikt agrāku pieaugumu (6-7 no rīta) , Kamēr insulīns ieviesa nakti turpina saglabāt normālu glicēmijas līmeni.
Otrā insulīna NPH injekcija parasti tiek veikta pirms brokastīm kopā ar īsa (Ultrashort) darbības injekciju. Šādā gadījumā deva ir izvēlēta galvenokārt, pamatojoties uz glycēmijas līmeni galveno dienas ēdienu (pusdienas, vakariņas); Turklāt tas var ierobežot hipoglikēmijas attīstību intervālos starp ēdienreizēm, piemēram, pusdienlaikā, starp brokastīm un pusdienām.
Visa deva insulīns ilgstoša darbība(Glargin) tiek ieviesta reizi dienā, bet nav būtiski, kādā laikā. Kinētika
glargin insulīni un detektīvs ir labvēlīgāki attiecībā uz hipoglikēmijas risku, tostarp nakti.
Īss vai ultrashort insulīna deva pat pirmajā pacientam, insulīna galamērķis būs atkarīgs no izmantoto ogļhidrātu daudzuma (maizes vienības) un glicēmijas līmenis pirms injekcijas. Nosacīti, pamatojoties uz ikdienas ritmu insulīna sekrēcijas, apmēram 1/4 no īstermiņa darbības insulīna (6-8 vienības) tiek dota vakariņām, atlikušā deva aptuveni vienādi sadalīts brokastīs un pusdienās (10-12 vienības). Jo augstāks ir glikēmijas sākotnējais līmenis, jo mazāk tas samazināsies ar ievietotā insulīna vienību. Īsa darbības insulīna injekcija tiek veikta 30 minūtes pirms ēšanas, ultrashort darbība tieši pirms ēšanas vai pat tūlīt pēc ēšanas. Īstermiņa insulīna devas atbilstība tiek novērtēta glycēmijas 2 stundu laikā pēc ēšanas un pirms nākamās maltītes.
Lai aprēķinātu insulīna devu ar intensīvu insulīna terapiju, tas ir pietiekami skaita skaitu X, pamatojoties uz ogļhidrātu komponentu. Tajā pašā laikā, ne visi ogļhidrātu produkti tiek ņemti vērā, bet tikai tā saukto aprēķināto. Pēdējais ietver kartupeļus, graudu produktus, augļus, šķidros piena un saldos produktus. Produkti, kas satur nepietiekami pārvaldāmu ogļhidrātus (vairums dārzeņu) netiek ņemti vērā. Ir izstrādātas īpašas apmaiņas tabulas, kuras palīdzību viņš, izsakot ogļhidrātu daudzumu, jūs varat aprēķināt nepieciešamo devu insulīna. Viens XE atbilst 10-12 g ogļhidrātu (10.7. Tabula).
Pēc pārtikas, kas satur 1 x, glycēmijas līmenis palielinās par 1.6-2.2 mmol / l, ti. Aptuveni tik daudz, cik glikozes līmenis tiek samazināts, ieviešot 1 U. insulīnu. Citiem vārdiem sakot, par katru Hee, kas atrodas pārtikā, kas plānots ēst, ir jāievieš iepriekš (atkarībā no dienas dienas) apmēram 1 insulīna vienības. Turklāt mums ir jāreģistrē glikēmijas līmeņa pašpārvaldes rezultāti, kas tiek veikti pirms katras injekcijas, un dienas laikā (apmēram 2 insulīna vienības uz 1 EB no rīta un pusdienās, 1 vienības 1 x - vakariņām). Tātad, ja ir jāatklāj hiperglikēmija, būtu jāpalielina insulīna deva, kas aprēķināta saskaņā ar gaidāmo maltīti (ziņā XE skaitu), un otrādi, ja tiek atklāts hipoglikēmija, insulīns tiek ieviests mazāk.
Tabula. 7.7.Līdzvērtīga produktu nomaiņa, kas veido 1 x
 Piemēram, ja pacients ir 30 minūtes līdz plānotajām vakariņām, kas satur 5 hehe, glycēmijas līmenis ir 7 mmol / l, tas ir jāievieš 1 vienības glikēmijai, lai samazinātu parasto līmeni: no 7 mmol / l apmēram 5 mmol / l. Turklāt uz pārklājuma 5 x jāievieš 5 auzulīns. Tādējādi pacients šajā gadījumā ieviesīs 6 vienības īsu vai ultrashort darbību.
Piemēram, ja pacients ir 30 minūtes līdz plānotajām vakariņām, kas satur 5 hehe, glycēmijas līmenis ir 7 mmol / l, tas ir jāievieš 1 vienības glikēmijai, lai samazinātu parasto līmeni: no 7 mmol / l apmēram 5 mmol / l. Turklāt uz pārklājuma 5 x jāievieš 5 auzulīns. Tādējādi pacients šajā gadījumā ieviesīs 6 vienības īsu vai ultrashort darbību.
Pēc SD-1 izpausmes un insulīna terapijas sākuma ilgu laiku insulīna nepieciešamība var būt maza un ir mazāka par 0,3-0,4 vienībām / kg. Šis periods ir norādīts kā remisijas fāze, vai "Medusmēnesis".Pēc hiperglikēmijas un ketoacidozes perioda, kas nomāc insulīna sekrēciju, ir 10-15% ar konservētiem β-šūnām, hormonālo metālu traucējumu kompensācija, ieviešot insulīna, atjauno šo šūnu funkciju, kas pēc tam uzņemas insulīna korpusa nodrošināšanu minimālais līmenis. Šis periods var turpināties no vairākām nedēļām līdz vairākiem gadiem, bet galu galā, jo autoimūna iznīcināšana atlikušās β-šūnas, "medusmēneša" beidzas.
Diētaar SD-1 apmācītiem pacientiem, kuriem pieder pašpārvaldes prasmes un atlases insulīna devas, var liberalizēt, ti.e. tuvojas bez maksas. Ja pacientam nav pārpalikuma vai ķermeņa svara deficīta, diētai jābūt
izocalorian. Galvenais pārtikas komponents SD-1 ir ogļhidrāti, kuriem jābūt apmēram 65% no ikdienas kalormateriālu. Priekšroka jāpiešķir produktiem, kas satur sarežģīti, lēnām sūkšanas ogļhidrātus, kā arī produktus, kas bagāti ar pārtikas audiem. Produkti, kas satur ogļhidrātus (milti, salds), jāizvairās. Proteīnu īpatsvars ir jāsamazina līdz 10-35%, kas palīdz samazināt risku attīstīt mikroangiopātiju, un tauku īpatsvars - līdz 25-35%, un ierobežotajiem taukiem jābūt veidot līdz 7% no kalormateriālu , kas samazina aterosklerozes risku. Turklāt ir nepieciešams izvairīties no alkoholisko dzērienu, īpaši spēcīgu.
Ir neatņemama sastāvdaļa, kas strādā ar pacientu ar SD-1 un tās efektīvas kompensācijas ķīlu pacientu apmācība.Dzīves laikā pacientam ir jābūt atkarīgam no daudziem faktoriem, lai mainītu insulīna devu. Acīmredzot tas prasa īpašas prasmes, ka pacients ir jāapmāca. "Pacienta SD-1 skola" tiek organizēta endokrinoloģiskās slimnīcās vai ambulatorajā un pārstāv 5-7 strukturētas klases, kurās ārsts vai speciāli apmācīts medmāsa interaktīvā režīmā, izmantojot dažādus vizuālos ieguvumus, veic pacientu apmācības principus pašnodarbināts.
Prognoze
Ja nav insulīna terapijas, SD-1 pacients neizbēgami nomirst no ketoacidotiska koma. Ar nepietiekamu insulīna terapiju, pret to, kuras fona nav sasniegti CD kompensācijas kritēriji, un pacients atrodas hroniskas hiperglikēmijas stāvoklī (7.3. Tabula), novēlotas komplikācijas (7.8. Punkts) sāk attīstīties un progresēt. Ar SD-1, vislielākā klīniskā nozīme šajā sakarā ir izpausmes diabēta microdgium (nefropātija un retinopātija) un neiropātija (diabēta pēdu sindroms). Makroangiopātija ar SD-1 priekšplānā ir salīdzinoši reti.
7.6. 2. tipa cukura diabēts
2. tipa cukura diabēts- hroniska slimība, kas izpaužas ogļhidrātu apmaiņas pārkāpums ar hiperglikēmijas attīstību insulīna rezistences un sekrēcijas β-šūnu disfunkcijas dēļ, \\ t
kā arī lipīdu metabolisms ar aterosklerozes attīstību. Tā kā pacientu nāves un invaliditātes galvenais iemesls ir sistēmiskās aterosklerozes komplikācijas, SD-2 dažreiz tiek saukta par sirds un asinsvadu slimībām.
Tabula. 7.8.2. tipa cukura diabēts
 Etioloģija
Etioloģija
SD-2 ir daudzfaktoru slimība ar iedzimtu predispozīciju. SD-2 saskaņotība vienā reizē dvīņi sasniedz 80% vai vairāk. Lielākā daļa pacientu ar SD-2 norāda uz SD-2 klātbūtni tuvākajiem radiniekiem; SD-2 klātbūtnē vienā no vecākiem, tās pēcnācēja iespējamība dzīvē ir 40%. Kurš viens gēns, kura polimorfisms nosaka noslieci uz SD-2, netika atklāts. Vides faktoriem ir liela nozīme, īstenojot iedzimtu noslieci uz SD-2. SD-2 riska riska faktori ir:
Aptaukošanās, īpaši viscerāls (skatīt 11.2. Punktu);
Etniskā piederība (jo īpaši, mainot tradicionālo dzīvesveidu rietumu daļā);
Mazkustīgs dzīvesveids;
Diētas iezīmes (augsts rafinētu ogļhidrātu un zema šķiedru satura patēriņš);
Artēriju hipertensija.
Patogenēze
Patogenētiski SD-2 ir neviendabīga vielmaiņas traucējumu grupa, tieši nosaka tās nozīmīgo klīnisko neviendabību. Tās patoģenēzes pamatā ir insulīna rezistence (samazinājums par glikozes izmantošanu ar audu insulīnu), kas tiek īstenots pret β-šūnu sekrēcijas disfunkcijas fonu. Tādējādi ir pārkāpts jutības līdzsvars pret insulīnu un insulīna sekrēciju. Sekretors disfunkcijaβ - flotetas ir palēnināt "agrīnās" sekretu insulīna emisiju, reaģējot uz glikozes līmeni asinīs. Tajā pašā laikā, pirmais (ātrs) sekrēcijas posms, kas atrodas iztukšo vezikulu ar uzkrāto insulīnu, faktiski nav klāt; 2. (lēni) sekrēcijas posms tiek veikts, reaģējot uz stabilizējošo hiperglikēmiju nepārtraukti, tonizējošā režīmā, un, neskatoties uz pārmērīgu sekrēciju insulīna, glicēmijas līmenis pret insulīna pretestības fonu nav normalizēta (7.8. Att.).
Hiperinsulinēmijas sekas ir samazināt insulīna receptoru jutīgumu un skaitu, kā arī apspiešanu
pēc receptoru mehānismi veicina insulīna efektu (insulīna pretestība).Galvenā glikozes konveijera saturs muskuļu un tauku šūnās (glut-4) tiek samazināts par 40% personām ar viscerālu aptaukošanos un 80% personām ar SD-2. Sakarā ar hepatocītu un portāla hiperinsulinēmijas rezistenci, \\ t glikozes hiperprodukcija, aknas,un hiperglikēmija attīstās, kas ir atklāts vairumā pacientu ar SD-2, tostarp slimības sākumposmā.
Hiperglikēmija pati negatīvi ietekmē β-šūnu sekrēcijas darbības veidu un līmeni (glikozotoksicitāti). Ilgu laiku, gadu gaitā un gadu desmitos, esošā hiperglikēmija galu galā noved pie izzušanas insulīna produktiem β-šūnas, un daži simptomi var parādīties pacientam. insulīna deficīts- novājēšanu, ketozi ar saistītām infekcijas slimībām. Tomēr atlikušie insulīna produkti, kas ir pietiekami, lai novērstu ketoacidozi, gandrīz vienmēr ir saglabāta SD-2.
Epidemioloģija
SD-2 definē SD epidemioloģiju kopumā, jo tā veido aptuveni 98% no šīs slimības gadījumiem. SD-2 izplatība atšķiras dažādās valstīs un etniskajās grupās. Eiropas
 Fig. 7.8.Secretor disfunkcija β-šūnu ar 2. tipa cukura diabētu (1. straujās insulīna sekrēcijas fāzes zudums)
Fig. 7.8.Secretor disfunkcija β-šūnu ar 2. tipa cukura diabētu (1. straujās insulīna sekrēcijas fāzes zudums)
valstis, ASV un Krievijas Federācija, tas ir aptuveni 5-6% iedzīvotāju. Ar vecumu SD-2 sastopamība palielinās: starp pieaugušajiem SD-2 izplatība ir 10%, starp cilvēkiem, kas vecāki par 65 gadiem sasniedz 20%. SD-2 biežums ir 2,5 reizes lielāks starp Amerikas vietējām iedzīvotājiem un Havaju salām; Starp indiešu PIMA cilts (Arizona) sasniedz 50%. Starp Indijas, Ķīnas, Čīles un Āfrikas valstu iedzīvotājiem, kas vada tradicionālo dzīvesveidu, SD-2 izplatība ir ļoti zema (mazāk nekā 1%). No otras puses, starp imigrantiem rietumu rūpnieciskajās valstīs tas sasniedz ievērojamu līmeni. Tātad, starp imigrantiem no Indijas un Ķīnas, dzīvo Amerikas Savienotajās Valstīs un Apvienotajā Karalistē, SD-2 izplatība sasniedz 12-15%.
Kurš prognozē diabēta pacientu skaita pieaugumu par 122% nākamo 20 gadu laikā (no 135 līdz 300 miljoniem). Tas ir saistīts gan ar iedzīvotāju pakāpenisku novecošanu, gan ar urbanizētā dzīvesveida izplatīšanu un pasliktināšanos. Pēdējos gados ir bijusi nozīmīga "atjaunošanās" SD-2 un izaugsmi tās sastopamības starp bērniem.
Klīniskās izpausmes
Vairumā gadījumu, izteiktas klīniskās izpausmes nav klāt,un diagnoze ir izveidota ikdienas definīcijā Glikēmijas līmenī. Slimība parasti izpaužas vairāk nekā 40 gadu vecumā, bet lielākā daļa pacientu ir aptaukošanās un citas sastāvdaļas vielmaiņas sindromu (skatīt 11.2 punktu). Pacienti neuzliek sūdzības par darba spēju, ja nav citu iemeslu. Sūdzības par slāpēm un poliūriju reti sasniedz ievērojamu smagumu. Diezgan bieži pacienti ir nobažījušies par ādu un maksts niezi, un tāpēc tie vēršas pie dermatologiem un ginekologiem. Jo daudzus gadus (vidēji, apmēram 7 gadi), daudzi pacienti slimības atklāšanas laikā klīniskajā attēlā, slimības identificēšanas laikā klīniskajā attēlā bieži dominē no faktiskās izpausmes SD-2 pirms diagnozes. sMPTOMI un SDS sarežģījumu izpausmes.Turklāt pirmā pacienta apelācija ar SD-2 medicīniskai palīdzībai ir ļoti bieži, pateicoties vēlu komplikācijām. Tātad, pacienti var tikt hospitalizēti ķirurģiskajās slimnīcās ar kājām bojājumiem (diabēta pēdu sindroms), \\ tkontakti Saistīt progresīvo redzējumu uz Oftalmologiem (diabētiskā retinopātija), \\ thospitalizēti ar sirdslēkmi, insults
tami, slīps kāju kuģu sakāvi iestādē, kur viņi vispirms atrast hiperglikēmiju.
Diagnostika
Diagnostikas kritēriji, vienādi visiem SD veidiem, ir sniegti 7.3. Punktā. SD-2 diagnoze lielākā daļa ir balstīta uz hiperglikēmijas atklāšanu personām ar tipiskām SD-2 klīniskajām pazīmēm (aptaukošanās, vecums vairāk nekā 40-45 gadi, pozitīva ģimenes vēsture SD-2, citas sastāvdaļas metabolisko sindromu ), ja nav klīniskās un laboratorijas pazīmes absolūtā insulīna deficītu (izteikts svara zudums, ketoze). SD-2 augstās izplatības kombinācija, kas raksturīga ilgai asimptomātiskai plūsmai un iespējai novērst savas smagās komplikācijas, ievērojot agrīnu diagnozi, iepriekš noteikto nepieciešamību skrīningstiem. Pārbaude, lai izslēgtu SD-2 starp indivīdiem bez slimības simptomiem. Galvenais tests, kā norādīts, ir definīcija glikēmijas līmenis ir tukšs kuņģis.Tas tiek parādīts šādās situācijās:
1. Visi cilvēki ir vecāki par 45 gadiem, jo \u200b\u200bīpaši pārmērīgi ķermeņa masas (CMT vairāk nekā 25 kg / m 2) ik pēc 3 gadiem.
2. Mazākajā vecumā, klātbūtnē lieko ķermeņa masu (ĶMI ar vairāk nekā 25 kg / m 2) un papildu riska faktoriem, kas ietver:
Mazkustīgs dzīvesveids;
SD-2 tuvākajiem radiniekiem;
Pieder pie valsts attīstības SD-2 (Āfrikas amerikāņi, Latīņamerikāņi, vietējie amerikāņi, uc);
Sievietes, kas dzemdēja bērnu, kas sver vairāk nekā 4 kg, un / vai gestācijas diabēta klātbūtnē kā vēsture;
Artērijas hipertensija (≥ 140/90 mm);
HDL līmenis\u003e 0,9 mmol / l un / vai triglicerīdi\u003e 2,8 mmol / l;
Policistiska olnīcu sindroms;
NTG un NGN;
Sirds un asinsvadu slimības.
Nozīmīgs SD-2 biežuma pieaugums bērniem nosaka nepieciešamību skrīninga definīciju glicēmijas līmenī bērniem un pusaudžiem(sākot no 10 gadiem ar intervālu 2 gadus vai sākumā
pubertata, ja viņš notika agrākā vecumā), kas pieder pie lielākas riska grupām, uz kuru bērni pieder ar ķermeņa masas pārpilnību(ĶMI un / vai ķermeņa svars\u003e 85 procentile, atbilstošs vecums vai vairāk nekā 120% svars attiecībā uz ideālu) kombinācijā ar diviem uzskaitītajiem papildu riska faktoriem: \\ t
SD-2 starp radiniekiem pirmās vai otrās radniecības;
Pieder augsta riska valstspiederībai;
Klīniskās izpausmes, kas saistītas ar insulīna rezistenci (Acanthosis nigricans,arteriālā hipertensija, dislipidēmija);
SD, ieskaitot gestācijas, māte.
Diferenciāldiagnoze
SD-2 un SD-1 diferenciālā diagnoze, kuru principi ir aprakstīti 7.5. Punktā, ir aprakstīti 7.5. Punktā (7.6. Tabula). Kā norādīts, vairumā gadījumu tas ir balstīts uz klīniskā attēla datiem. Gadījumos, kad CD veida izveide atbilst grūtībām, vai ir aizdomas par dažiem retiem SD variantiem, tostarp iedzimtu sindromiem, vissvarīgākais praktiskais jautājums, uz kuru ir nepieciešams atbildēt, ir tas, vai pacients Nepieciešams pacients insulīna terapijā.
Ārstēšana
SD-2 ārstēšanas galvenās sastāvdaļas ir: diētas terapija, fiziskās aktivitātes paplašināšana, cukura terapija, novēlotu CD komplikāciju novēršana un ārstēšana. Tā kā vairums pacientu ar SD-2 cieš aptaukošanos, diētai jābūt vērstai uz samazinātu svaru (hipohalorial) un novēlotu komplikāciju novēršanu, galvenokārt makroangiopātiju (aterosklerozi). Hipolāru diētatas ir nepieciešams visiem pacientiem ar lieko ķermeņa masu (ĶMI 25-29 kg / m 2) vai aptaukošanās (ĶMI\u003e 30 kg / m 2). Vairumā gadījumu būtu ieteicams samazināt ēdiena ikdienas malu līdz 1000-1200 kcal sievietēm un līdz 1200-1600 kcal vīriešiem. SD-2 galveno pārtikas komponentu ieteicamā attiecība ir līdzīga ar SD-1 (ogļhidrātu - 65%, olbaltumvielas 10-35%, tauki līdz 25-35%). Izmantot alkoholstas ir nepieciešams, lai ierobežotu sakarā ar to, ka tas ir būtisks avots papildu kaloriju, turklāt, alkohola uzņemšana uz fona Tera
fDI ar sulfonilurīnvielu un insulīnu var izraisīt hipoglikēmijas attīstību (sk. 7.7.3. Punktu).
Ieteikumi fiziskās aktivitātes paplašināšanajābūt individuālam. Sākumā, aerobās slodzes (pastaigas, peldēšana) ar mērenu intensitātes ilgumu 30-45 minūtes 3-5 reizes dienā (apmēram 150 minūtes nedēļā) ir ieteicama. Nākotnē ir nepieciešams pakāpeniski palielināt fizisku slodzi, kas ievērojami palīdz samazināt un normalizēt ķermeņa svaru. Turklāt fiziskā piepūle palīdz samazināt insulīna rezistenci un ir hipoglikitizējošs efekts. Dietoterapijas kombinācija un fiziskās slodzes paplašināšana bez cukura narkotiku iecelšanas ļauj saglabāt SD kompensāciju saskaņā ar noteiktajiem mērķiem (7.3. Tabula) Aptuveni 5% pacientu ar SD-2.
Preparāti cukurniedru terapijaja SD-2 var iedalīt četrās galvenajās grupās.
I. Preparāti, kas veicina insulīna rezistences samazināšanu (jutīgie).Šajā grupā ietilpst metformīns un tiazolidions. Metformīnsir vienīgais, ko pašlaik izmanto zāles no grupas biguanīdi.Tās darbības mehānisma galvenās sastāvdaļas ir:
1. Glikoneogeness nomākšana aknās (glikozes produktu samazinājums ar aknām), kas noved pie glycēmijas līmeņa samazināšanās tukšā dūšā.
2. Insulīna rezistences samazināšana (glikozes apglabāšanas pieaugums ar perifēro audiem, galvenokārt ar muskuļiem).
3. Avnaeobic glikolīzes aktivizēšana un glikozes sūkšanas samazināšana tievajās zarnās.
Metformīnstas ir pirmās cukura terapijas izvēles preparāts pacientiem ar SD-2, aptaukošanos un hiperglikēmiju tukšā dūšā. Sākotnējā deva ir 500 mg naktī vai vakariņās. Nākotnē deva pakāpeniski palielinās līdz 2-3 gramiem 2-3 pieņemšanām. Starp blakusparādībām salīdzinoši bieži pastāv dispeptiskas parādības (caureja), kas parasti ir pārejoša un iziet patstāvīgi pēc 1-2 nedēļām, saņemot narkotiku. Tā kā metformīna nav stimulējoša ietekme uz insulīna produktiem, uz monoterapijas fona ar šo narkotiku hipoglikēmiju
attīstīties (tās darbība ir noteikta kā antihiperglikēmija, nevis kā hipoglikēmiska). Kontrindikācijas metformīna iecelšanai ir grūtniecība, smaga sirds, aknu, nieru un citu orgānu kļūme, kā arī cita ģenēzes hipoksiskās valstis. Ļoti reta komplikācija, kas rodas, ieceļot metformīnu, neņemot vērā iesniegtos kontrindikācijas, ir laktacidoze, kas ir anaerobās glikolīzes hiperaktivācijas sekas.
Tiazoliddions(Pioglitazons, rosigtyazons) ir γ-receptoru agonisti, kas aktivizēta peroksizā (PAR-γ). Tiazolidindions aktivizē glikozes un lipīdu metabolismu muskuļu un taukaudos, kas noved pie endogēnās insulīna aktivitātes pieauguma. Lai novērstu insulīna rezistenci (insulīna sensitizers). Pioglitazona dienas deva ir 15-30 mg dienā, rožlitazona - 4-8 mg (uz 1-2 uzņemšanu). Tiazolidingionu kombinācija ar metformīnu ir ļoti efektīva. Kontrindikācija tiazolidjona nolūkā ir aknu transamināžu (2,5 vai vairāk vai vairāk) līmenis. Papildus hepatotoksicitātei tiazolidīna gala blakusparādības ietver šķidruma un pietūkuma kavēšanos, kas biežāk attīstās insulīna preparātu kombinācijas laikā.
II. Preparāti, kas ietekmēβ - labāk un veicināt insulīna sekrēcijas stiprināšanu.Šajā grupā ietilpst sulfonilurīnvielas un māla preparāti (prandial glikēmijas regulatori), kas galvenokārt tiek izmantoti, lai normalizētu glicēmijas līmeni pēc ēšanas. Galvenais mērķis sulfonilmochevines preparāti(PSM) ir aizkuņģa dziedzeru salu β-šūnas. PSM saistās ar β-šūnu membrānu ar konkrētiem receptoriem. Tas noved pie ATP atkarīgo kālija kanālu slēgšanas un šūnu membrānas depolarizācijas, kas savukārt veicina kalcija kanālu atvēršanu. Kalcija plūsma β-šūnā izraisa to sabrukumu un insulīna emisiju asinīs. Klīniskajā praksē tiek izmantoti diezgan daudz PSM, kas atšķiras no cukura iedarbības ilguma un smaguma pakāpē (7.9. Tabula).
Tabula. 7.9.Sulfonilmochevines preparāti
 PSM galvenā un diezgan bieža blakusparādība ir hipoglikēmija (sk. 7.7.3. Punktu). Tas var notikt ar narkotiku pārdozēšanu, tās kumulāciju (nieru mazspēju), \\ t
PSM galvenā un diezgan bieža blakusparādība ir hipoglikēmija (sk. 7.7.3. Punktu). Tas var notikt ar narkotiku pārdozēšanu, tās kumulāciju (nieru mazspēju), \\ t
neatbilstība diētai (ēdienreizes, alkohola uzņemšana) vai režīmā (ievērojams fizisks piepūle, pirms kura PSM deva nav samazināta vai ogļhidrāti netiek ņemti).
Uz grupu hinīdi(Glikēmijas prionu regulatori) repaglinīds(benzoskābes atvasinājums; dienas deva 0,5-16 mg / dienā) un nateglinida(D-fenilalanīna atvasinājums; dienas deva 180-540 mg dienā). Pēc narkotiku lietošanas preparāti ātri un atgriezeniski ar sulfonilturevīna receptoru uz β šūnas, kā rezultātā notiek īss insulīna līmeņa pieaugums, kas atdarina tās sekrēcijas pirmo fāzi ir normāli. Preparāti tiek pieņemti 10-20 minūšu laikā uz galvenajām maltītēm, parasti 3 reizes dienā.
III. Preparāti, kas samazina glikozes uzsūkšanos zarnās.
Šī grupa ietver AKABOZ un Guar sveķi. Acarbozes darbības mehānisms ir atgriezeniska tievo zarnu α-glikozidānu bloķēšana, kā rezultātā ogļhidrātu secīgas fermentācijas un sūkšanas procesi palēninās, rezorbcijas ātrums un glikozes uzņemšana aknās samazinās un samazināts pēcprāga glikēmijas līmenis. Sākotnējā Acarbozes deva ir 50 mg 3 reizes dienā, nākotnē devu var palielināt līdz 100 mg 3 reizes dienā; Zāles tiek pieņemtas tieši pirms ēšanas vai pārtikas laikā. Galarbosas galvenā blakusparādība ir zarnu dispepsija (caureja, meteorisms), kas ir saistīta ar nesaņemamo ogļhidrātu saņemšanu resnās zarnā. Kostizācijas efekts akarbozi ir ļoti mērena (7.10 tabula).
Klīniskajā praksē tabletētas saharincas zāles tiek efektīvi apvienotas ar otru un ar insulīna preparātiem, jo \u200b\u200blielākā daļa pacientu tiek vienlaicīgi definēti kā merkors un postprandiālais hiperglikēmija. Ir daudz fiksētās kombinācijaspreparāti vienā tabletē. Visbiežāk vienā tabletē ir apvienots metformīns ar dažādiem PSM, kā arī metformīnu ar tiazolidīniem.
Tabula. 7.10.Darbības mehānisms un iespējamā tableeto cukura narkotiku efektivitāte
 Iv. Insulīni un analogi insulīnu
Iv. Insulīni un analogi insulīnu
Noteiktā posmā insulīna preparāti sāk saņemt līdz 30-40% pacientu ar SD-2. Indikācijas par insulīna terapiju SD-2 ir parādītas 7.4. Punkta sākumā. Visbiežāk iespēja tulkot pacientiem ar SD-2 par insulīna terapiju, ir piešķirt ilgstošas \u200b\u200bdarbības insulīnu (insulīna NPH, Glargin vai Detech) kombinācijā ar saņemtajām tabletēm uz cukura zālēm. Situācijā, kad glycēmijas līmenis nav iespējams kontrolēt metformīna vai pēdējās kontrindicētās iecelšanu, pacients tiek piešķirts vakarā (nakti) insulīna injekcijai. Ja nav iespējams kontrolēt, izmantojot tabuletasisku narkotiku kā dzīvsudrabu un pēcprāga glikēmiju, pacients tiek tulkots Monoinsulinatherapy. Parasti ar SD-2 insulīna terapiju tiek veikta tā sauktajā "Tradicionālā" shēma, \\ tkas nozīmē iecelšanu fiksēto devu insulīna ilgstošas \u200b\u200bun īsas darbības. Šajā plānā
standarta maisījumi insulīnu, kas satur īsu (ultrashort) un ilgstošu darbību vienā pudelē ir ērti. Tradicionālās insulīna terapijas izvēli nosaka fakts, ka saskaņā ar SD-2, to bieži ieceļ vecāka gadagājuma pacientiem, kuru mācīšanās līdz neatkarīgām insulīna devas izmaiņām ir sarežģīta. Turklāt intensīva insulīna terapija, kuras mērķis ir saglabāt ogļhidrātu apmaiņas kompensāciju līmenī, kas tuvojas normoglikēmijai, palielina hipoglikēmijas risku. Ja jauniešiem, gaisma hipoglikēmija nav nopietna apdraudēta, vecāka gadagājuma pacientiem ar samazinātu slieksni sajūtas hipoglikēmijas, tie var būt ļoti nelabvēlīgas sekas no sirds un asinsvadu sistēmas. Var iecelt jaunus pacientus ar SD-2, kā arī pacientiem efektīvas mācīšanās iespējas, intensīvu insulīna terapijas versiju.
Prognoze
Galvenais iemesls invaliditātes un nāves pacientu ar SD-2 ir novēlotas komplikācijas (sk. 7.8. Punktu), visbiežāk diabēta makroangiopātija. Dažu novēlotu komplikāciju izstrādes risku nosaka attiecīgajās nodaļās apspriestos faktori. Universāls riska faktors to attīstībai ir hroniska hiperglikēmija. Tādējādi samazinājums līmeņa HBA1C pacientiem ar SD-2 par 1% noved pie kopējā mirstības samazināšanās par aptuveni 20%, par 2% un 3% - par aptuveni 40%, attiecīgi
7.7. Akūtas diabēta komplikācijas
7.7.1. Diabēta ketoacidoze
Diabēta ketoacidoze (DCA)- SD-1 dekompensācija insulīna absolūtā trūkuma dēļ, ja nav savlaicīgas ārstēšanas ar beigu ketoacidotisku komu (QC) un nāvi.
Etioloģija
DCA cēlonis ir absolūts insulīna deficīts. Tas vai ka DCA smagums ir noteikts vairumā pacientu laikā, kad izpausme SD-1 (10-20% no visiem DCA gadījumiem).
Pacients ar diagnosticētu SD-1 DCA diagnozi var attīstīties, kad insulīns tiek pārtraukts, bieži vien pacients (13% no DCA gadījumiem), uz vienlaicīgu slimību fona, galvenokārt infekciozā, ja nav palielinājies insulīna deva
Tabula. 7.11.Diabēta ketoacidoze
 Līdz 20% no DC-1 attīstības lietām jauniem pacientiem ar SD-1 ir saistīti ar psiholoģiskām problēmām un / vai pārtikas uzvedības traucējumiem (bailes no svara pieauguma, bailes no hipoglikēmijas, pusaudžu problēmas). Diezgan biežs DCA cēlonis vairākās valstīs ir
Līdz 20% no DC-1 attīstības lietām jauniem pacientiem ar SD-1 ir saistīti ar psiholoģiskām problēmām un / vai pārtikas uzvedības traucējumiem (bailes no svara pieauguma, bailes no hipoglikēmijas, pusaudžu problēmas). Diezgan biežs DCA cēlonis vairākās valstīs ir
atcelt insulīna pacientam pats sakarā ar augstajām narkotiku izmaksām dažām iedzīvotāju nozarēm (7.11. Tabula).
Patogenēze
DCA patoģenēzes centrā ir absolūtais insulīna trūkums kombinācijā ar konvenciju palielināšanos, piemēram, glikagonu, kateholamīniem un kortizolu. Tā rezultātā ir ievērojams glikozes aknu produkts un tā rīcībā esošo traucējumu traucējumi, hiperglikēmijas pieaugums un ekstracelulārās telpas osmolaritātes traucējumi. Insulīna deficīts kombinācijā ar relatīvo pārsniegumu pret intrincējām hormoniem DCA noved pie atbrīvošanas brīvas taukskābes (lipolīze) un to nesaspiesta oksidēšanās aknās uz ketonu ķermeņiem (β-hidroksibutirāts, acetoacetāts, acetons), kā rezultātā hypercohemēmija attīstās, un nākotnē metabolisko acidozi. Izteiktas glikozes dēļ osmotisko diurēze attīstās, dehidratācija, nātrija zudums, kālijs un citi elektrolīti (7.9. Att.).
Epidemioloģija
Jaunu DCA gadījumu biežums ir 5-8 uz 1000 pacientiem ar SD-1 gadā un tieši atkarīgs no medicīnisko aprūpes slimnieku organizācijas līmeņa ar SD. Katru gadu Amerikas Savienotajās Valstīs notiek aptuveni 100 000 hospitalizācijas par DCA, vienlaikus ņemot vērā vienas pacienta izmaksas par hospitalizāciju 13 tūkstošus dolāru apmērā, vairāk nekā $ 1 miljards gadā tiek izlietots katru gadu uz Stacionāro DCA ārstēšanu. Krievijas Federācijā 2005. gadā DKA tika reģistrēta 4,31% bērnu, 4,75% no pusaudžiem un 0,33% pieaugušo pacientu ar SD-1.
Klīniskās izpausmes
Atkarībā no iemesla, atkarībā no iemesla, ko izraisa tā iemesls, var aizņemt no vairākām nedēļām līdz dienai. Vairumā gadījumu DCA ir pirms diabēta dekompensācijas simptomi, bet dažreiz viņiem nav laika, lai attīstītos. Klīniskie simptomi DCA ietver poliūriju, polidipsi, novājēšanu, izlijušas vēdera sāpes ("diabēta pseudoperithonite"), dehidratācija, izteikta vājums, acetona smarža no mutes (vai augļu smarža), pakāpeniski mākoņainas apziņas. Patiesa koma DCA nesen ir attīstījusies salīdzinoši reti agrīnās diagnostikas dēļ. Fiziskajos pētījumos tiek konstatētas dehidratācijas pazīmes: samazināšana
 Fig. 7.9. Cetoacidotic koma patoģenēze
Fig. 7.9. Cetoacidotic koma patoģenēze
turgors no ādas un blīvums acs āboli, tahikardija, hipotensija. Jaunajos gadījumos Kussmouul elpošana attīstās. Vairāk nekā 25% pacientu ar DCA izstrādā vemšanu, kas var atgādināt kafiju biezu krāsu.
Diagnostika
Tas ir balstīts uz klīnisko attēlu datiem, norādēm par pacienta SD-1 klātbūtni, kā arī laboratorijas pētījuma datus. DCA ir raksturīga hiperglikēmija (dažos gadījumos, nenozīmīga), ketonūrija, metaboliskā acidoze, hiperosmolitāte (7.12. Tabula).
Tabula. 7.12.Cukura diabēta komplikāciju laboratorijas diagnostika
 Izpētot pacientus ar akūtu SD dekompensāciju, ir jānosaka glicēmijas, kreatinīna un urīnvielas līmenis, elektrolītu, kuru pamata tiek aprēķināta efektīva osmolaritāte. Turklāt ir nepieciešama eskorts un zeme. Efektīva osmolaritāte(EO) tiek aprēķināts saskaņā ar šādu formulu: 2 *. Norma EO ir 285 - 295 mosm / l.
Izpētot pacientus ar akūtu SD dekompensāciju, ir jānosaka glicēmijas, kreatinīna un urīnvielas līmenis, elektrolītu, kuru pamata tiek aprēķināta efektīva osmolaritāte. Turklāt ir nepieciešama eskorts un zeme. Efektīva osmolaritāte(EO) tiek aprēķināts saskaņā ar šādu formulu: 2 *. Norma EO ir 285 - 295 mosm / l.
Lielākā daļa pacientu ar DCA tiek noteikti leikocitozeno kura smagums ir proporcionāls līmenim ketona ķermeņiem asinīs. Līmenis nātrijsparasti tas tiek samazināts sakarā ar osmotisko šķidruma izplūdi no intracelulārajām telpām ekstracelulāriem, reaģējot uz hiperglikēmiju. Retāk nātrija līmenis var tikt nepatiesi samazināts, kā rezultātā izteikta hiper-
trigliceridēmija. Līmenis kālijsserumu sākotnēji var paaugstināties, pateicoties tās kustībai no ekstracelulārajām telpām.
Diferenciāldiagnoze
Citi iemesli samaņas zudumam pacientiem ar SD. Diferenciāldiagnoze ar hiperosmolāru komu, neizraisa grūtības (attīstās vecāka gadagājuma pacientiem ar SD-2) un nav liela klīniskā vērtība, jo Abu valstu ārstēšanas principi ir līdzīgi. Ja nav iespējams ātri uzzināt pacienta apziņas zuduma iemeslu ar SD, tiek parādīts glikozes ieviešana, jo Hipoglikēmiskās valstis ir atrodamas daudz biežāk, un ātru pozitīvu dinamiku pret glikozes ieviešanas fonu ļauj uzzināt apziņas zuduma iemeslu.
Ārstēšana
DKA ārstēšana nozīmē rehidratāciju, hiperglikēmijas, elektrolītu traucējumu korekciju, kā arī slimību ārstēšanu, kas izraisīja diabēta dekompensāciju. Ārstēšana ir visoptimāli veic specializētas medicīnas iestādes atdzīvināšanas nodaļā. Pieaugušiem pacientiem bez stingras vienlaicīgas sirds patoloģijas, vēl pirms slimnīcas posmā kā primārais pasākums recerēšanaieteicams ieviest izotonisku šķīdumu (0,9% NaCl), aptuveni ar ātrumu litru stundā (apmēram 15-20 ml uz kilogramu svara stundā). Pirmajās ārstēšanas dienās ir jāpanāk pilnīga šķidruma deficīta atmaksa, kas ar DCA ir 100-200 ml uz kg svara. Ar vienlaicīgu sirdi vai nieru mazspēju, šis laika periods ir jāpalielina. Bērniem ieteicamais izotoniskā šķīduma tilpums rehidratācijas terapijai ir 10-20 ml uz kg ķermeņa masas stundā, un pirmajās 4 stundās tas nedrīkst pārsniegt 50 ml uz kg svara. Pilna rehidratācija ir ieteicams sasniegt aptuveni 48 stundas. Pēc paralēlas insulīna terapijas fona glycēmijas līmenis samazinās apmēram 14 mmol / l, iet uz 10% glikozes šķīduma pārliešanu, kas turpina rehidratāciju.
Pašlaik pieņēma "mazo devu" jēdzienu insulīnsĀrstēšanā DCA. Tiek izmantots tikai īss darbības insulīns. Optimālākā intravenoza izņēmuma izmantošana
lina. Intramuskulārais insulīna ieviešana, kas ir mazāk efektīva, iespējams, tikai ar mērenu DCA smagumu ar stabilu hemodinamiku un ja neiespējami intravenozai terapijai. Pēdējā gadījumā injekcijas tiek veiktas taisnā vēdera muskuļos, bet adata intramuskulāras injekcijas tiek likts uz insulīna šļirci (par uzticamu intramuskulāru hit), un uz šo adatu, insulīns tiek pieņemts darbā no pudeles šļircē .
Intravenozai insulīna ievadīšanai ir vairākas iespējas. Pirmkārt, insulīnu var ieviest "uz gumijas joslā" no infūzijas sistēmas, bet nepieciešamo insulīna daudzums tiek iegūts insulīna šļircē, pēc kura 1 ml izotonisks šķīduma iegūst. Līdz Glikēmijas līmenim, 14 mmol / l ir stundas pacients ieviesa 6-10 īsas darbības vienības; tālāk (Paralēli rehidratācijas šķīduma maiņai ar izotonisku par 10% glikozi)atkarībā no nosakāmo glikēmijas rādītāju laika insulīna deva tiek samazināta līdz 4-8 vienībām stundā. Glikēmijas līmeņa ieteicamā samazinājuma likme nedrīkst pārsniegt 5 mmol / l stundā. Vēl viens intravenozas insulīna terapijas iemiesojums nozīmē perfuzora lietošanu. Perpetuatora sagatavošanai 50 mg 50 mg 50 mg ir pievienots 50 mg 0,9% izotoniskā šķīduma. Ja tiek izvēlēts intramuskulārais ceļš insulīna ievadīšanas, 20 vienības īsu darbību sākotnēji ieviesta sākotnēji, pēc kura tā ir 6 vienības, un pēc sasniegšanas glycemia, 14 mmol / l deva tiek samazināta līdz 4 vienībām stundā. Pēc pilnīgas hemodinamikas stabilizēšanas un kompensācijas par skābju bāzes traucējumiem pacients tiek tulkots subkutānas insulīna injekcijās.
Kā norādīts, neskatoties uz nozīmīgo kālija deficītsĶermenī (kopējais zaudējums 3-6 mmol / kg), ar DCA tās līmeni pirms insulīna terapijas sākuma var nedaudz paaugstināt. Neskatoties uz to, sākums pārliešanu no kālija hlorīda šķīduma ieteicams veikt vienlaicīgi ar insulīna terapijas sākumu, ja plazmas kālija līmenis ir mazāks par 5,5 mmol / l. Veiksmīga kālija deficīta korekcija notiek tikai fona pH normalizācijas. Ar zemu pH, kālija uzņemšana ievērojami samazinās būtiski, saistībā ar to, ja iespējams, deva pārpildītā kālija hlorīda ir vēlams pielāgoties konkrētam pH indikatoram (7.13 tabula).
Tabula. 7.13.Kālija deficīta korekcijas shēma
 * Lai aprēķinātu, šādi dati:
* Lai aprēķinātu, šādi dati:
1 g kcl \u003d 13,4 mmol; 1 mmol kcl \u003d 0,075 g. KS1 4% šķīdumā: 100 ml - 4 g KS1, 25 ml - 1 g KS1, 10 ml 0,4 g KS1.
Bieži vien diabēta dekompensācijas iemesls ir infekcijas slimības(Pyelonefrīts, inficēts čūla ar diabēta pēdu sindromu, pneimoniju, sinusītu un tā tālāk.). Ir noteikums, saskaņā ar kuru ar DCA antibiotiku terapiju, tas ir paredzēts gandrīz visiem pacientiem ar apakšfilmu vai drudzi, pat ja nav redzamas infekcijas uzmanības centrā, jo faktiski par DCA, ķermeņa temperatūras pieaugums nav tipisks.
Prognoze
DCA mirstība ir 0,5-5%, bet lielākā daļa gadījumu ir saistīts ar novēlotu un nekvalificētu medicīnisko aprūpi. Mirstība ir augstākā (līdz 50%) vecāku pacientu vidū.
7.7.2. Hyperosmolar koma
Hyperosmolar koma(GOK) - reta akūta SD-2 komplikācija, attīstot sakarā ar izteiktu dehidratāciju un hiperglikēmiju pret absolūtas insulīna trūkuma neesamību, kam pievienots augsta mirstība (7.14. Tabula).
Etioloģija
GO, kā likums, attīstās vecāka gadagājuma pacientiem ar SD-2. Šādi pacienti visbiežāk ir vientuļi, dzīvo bez aprūpes, atstājot to stāvokli un pašpārvaldi un nepietiekami daudz šķidrumu. Bieži vien infekcija (diabēta pēdu sindroms, pneimonija, akūta pielonefrīts), smadzeņu darbības traucējumi noved pie dekompensācijas
asinsrites un citi apstākļi, kā rezultātā pacienti ir slikti pārvietojas, nelietojiet uz cukuru balstītas zāles un šķidrumu.
Tabula. 7.14.Hyperosmolar Coma (GOK)
 Patogenēze
Patogenēze
Pieaugošā hiperglikēmija un osmotiskā diurēze nosaka izrunāto dehidratāciju, kas iepriekš norādīto iemeslu dēļ nav aizpildīts no ārpuses. Hiperglikēmijas un dehidratācijas rezultāts ir plazmas hiperosmolārums. Kokvuma patoģenēzes sastāvdaļa ir insulīna relatīvais trūkums un pretpola hormonu pārpalikums, kas turpinās SD-2, insulīna atlikušais sekrēcija ir pietiekama, lai samazinātu lipolyāzi un ketogenēzi, kā rezultātā no kuriem nenotiek ketoacidoze.
Dažos gadījumos hiperlactatēmijas rezultātā var noteikt mērenu incektēšanu pret audu hipoperfūzijas fonu. Ar izteiktu hiperglikēmiju, lai saglabātu osmotisko līdzsvaru cerebrospinālā šķidrumā, nātrija saturs nāk no smadzeņu šūnām palielinās, kur kālija apmaiņā. Nervu šūnu pārraides potenciāls ir traucēts. Izstrādā apziņas progresīvo uztvērēju kombinācijā ar konvulsīvu sindromu (7.10. Att.).
Epidemioloģija
KV veido 10-30% akūtu hiperglikēmijas valstu un vecāka gadagājuma pacientiem ar SD-2 pacientiem ar SD-2. Aptuveni 2/3 no Keka gadījumu attīstās personām, kurām nav diagrammas.
Klīniskās izpausmes
Hiperosmolārā koma klīniskā attēla iezīmes ir:
Dehidratācijas un hipoperūzijas pazīmju un komplikāciju komplekss: slāpes, gļotādu sausums, tahikardija, artēriju hipotensija, slikta dūša, vājums, šoks;
Fokusa un vispārinātas krampji;
Drudzis, slikta dūša un vemšana (40-65% gadījumu);
Vienlaicīgas slimības un komplikācijas bieži atrodamas dziļo vēnu tromboze, pneimonija, smadzeņu ūdens traucējumi, gastroparēze.
Diagnostika
Tā pamatā ir klīniskā attēla dati, pacienta vecums un SD-2 vēsture, izteikta hiperglikēmija, ja nav Ketonūrijas un ketoacidozes. Tipiski laboratorijas pazīmes ir parādītas tabulā. 7.12.
 Fig. 7. .10.
Patogenēze hiperosmolāra koma
Fig. 7. .10.
Patogenēze hiperosmolāra koma
Diferenciāldiagnoze
Citas akūtas valstis attīstās pacientiem ar cukura diabētu, visbiežāk ar vienlaicīgu patoloģiju, kas izraisa izteiktu dekompensāciju SD.
Ārstēšana
Ārstēšana un uzraudzība KV, izņemot dažas funkcijas, neatšķiras no tām, kas aprakstītas ketoacidotiskās diabēta koma (7.7.1. Punkts):
Lielāks sākotnējās rehydation 1,5-2 litri uz 1 stundu; 1 L - 2. un 3. stundā, tad 500 ml / h izotonisks šķīdums nātrija hlorīda;
Nepieciešamība ieviest kālija saturošus šķīdumus parasti ir lielāks nekā ar ketoacidotisku koma;
Insulīna terapija ir līdzīga ar CC, bet insulīna nepieciešamība ir mazāka un glycēmijas līmenis nav jāsamazina ātrāk nekā 5 mmol / l stundā, lai izvairītos no smadzeņu tūskas attīstības;
Hipotoniskā šķīduma ieviešana (NaCl 0,45%) ir labāk, lai izvairītos no (tikai ar izteiktu hipernatrēmiju:\u003e 155 mmol / l un / vai efektīva osmolaritāte\u003e 320 MOS / l);
Ieviešot bikarbonātu, nav nepieciešams (tikai specializētās atdzīvināšanas nodalījumos ar acidozi ar pH< 7,1).
Prognoze
Mirstība pie Kuk ir augsts un ir 15-60%. Sliktākā prognoze vecāka gadagājuma pacientiem ar smagu pavadošo patoloģiju, kas bieži vien ir SD dekompensācijas cēlonis un KV attīstība.
7.7.3. Hipoglikēmija
Hipoglikēmija- samazinot glikozes līmeni asins serumā (<2,2- 2,8 ммоль/л), сопровождающее клинический синдром, характеризующийся признаками активации симпатической нервной системы и/или дисфункцией центральной нервной системы. Гипогликемия как лабораторный феномен не тождественен понятию «гипогликемическая симптоматика», поскольку лабораторные данные и клиническая картина не всегда совпадают.
Etioloģija
Insulīna preparātu pārdozēšana un tās analogi, kā arī sulfonilurīnvielas narkotikas;
Pārtikas trūkums, pamatojoties uz nemainīgu cukura terapiju;
Alkoholisko dzērienu pieņemšana;
Fiziska piepūle ar nemainītu cukura terapiju un / vai bez papildu ogļhidrātu uzņemšanas;
SD (autonomā neiropātija ar gastroparēzes, nieru mazspējas) un vairākām citām slimībām (virsnieru nepietiekams neveiksmes, hipotireoze, aknu mazspēja, ļaundabīgi audzēji) ar nemainīgu cukura terapiju (TSP saņemšanas un kumulācijas turpināšana uz fona nieru mazspēja, bijušās insulīna devas saglabāšana);
Insulīna ievadīšanas pārkāpums (intramuskulāra injekcija, nevis subkutānas);
Mākslīgo hipoglikēmiju (apzināta cukura narkotiku pārdozēšana pašam pacientam);
Organiskais hiperinsulinisms - insulīns (sk. 10.3. Punktu).
Patogenēze
Hipoglikēmijas patoģenēze ir pārkāpt līdzsvaru starp glikozes plūsmu asinīs, tās apglabāšanu, insulīna līmeni un konjunktūras hormoniem. Parasti glycēmijas līmenī 4,2-4,7 mmol / l, produkti un insulīna atbrīvošana no β-šūnām tiek nomākti. Glikēmijas līmeņa samazināšana, kas ir mazāka par 3,9 mmol / l, ir pievienots konkursa hormonu izstrādājumu (glikagona, kortizola, augšanas hormona, adrenalīna) stimulēšana. Neuroglikopēniskie simptomi attīstās ar glycēmijas līmeņa samazināšanos mazāk nekā 2,5-2,8 mmol / l. Pārdozēšanai insulīnsun / vai narkotikas sulfonilmochinahipoglikēmija attīstās sakarā ar tiešu hipoglikizēšanas efektu eksogēno vai endogēno hormonu. Pārdozēšanas gadījumā pēc sulfonilurīnvielas preparātiem, hipoglikēmijas simptomi var atkārtoti atkārtoti atkārtoti atkārtoti atkārtoti atkārtoti uzņemties to, ka narkotiku diapazona ilgums var sasniegt dienu vai vairāk. TSP, kam nav stimulējoša ietekme uz insulīna produktiem (metformīnu, tiazolidindions), hipoglikēmija pašas nevar izraisīt paši, bet, kad tie pievieno sulfonilurīnvielu vai insulīnu, tās uzņemšana tajā pašā devā var izraisīt hipoglikēmiju dēļ Kombinētās terapijas shah-barošanas efekta kumulācija (7.15. Galds).
Tabula. 7.15.Hipoglikēmija
 Gala galds. 7.15
Gala galds. 7.15
 Saņemot alkoholstas notiek glukeneses apspiešana aknās, kas ir vissvarīgākais faktors pretēji hipoglikēmiju. Fiziskais vingrinājumsaizsargājiet insulīna atkarīgo glikozes izmantošanu, kuru dēļ ir hipoglikēmijas cēlonis nemainīgas cukura-sakramenta terapijas un / vai ja nav papildu uzņemšanas ogļhidrātu.
Saņemot alkoholstas notiek glukeneses apspiešana aknās, kas ir vissvarīgākais faktors pretēji hipoglikēmiju. Fiziskais vingrinājumsaizsargājiet insulīna atkarīgo glikozes izmantošanu, kuru dēļ ir hipoglikēmijas cēlonis nemainīgas cukura-sakramenta terapijas un / vai ja nav papildu uzņemšanas ogļhidrātu.
Epidemioloģija
Gaisma, ātri burbulis hipoglikēmija pacientiem ar SD-1, saņemot intensīvu insulīna terapiju, var attīstīties vairākas reizes nedēļā, un relatīvi nekaitīga. Uz vienu pacientu, kas ir intensīva insulīna terapija, gadā veido 1 gadījumā smagu hipoglikēmiju. Vairumā gadījumu naktī attīstās hipoglikēmija. Ar SD-2 20% pacientu, kas saņēma insulīnu, un 6% saņem sulfonilurīnvielas preparātus, vismaz vienu epizode smaga hipoglikēmija attīstās vismaz vienā epizodē.
Klīniskās izpausmes
Divas galvenās simptomu grupas ir atšķirtas: adrenerģiska, kas saistīta ar simpātiskās nervu sistēmas aktivizēšanu un adrenalīna adrenalīnu emisiju un neuroglikopēnisko, kas saistīts ar centrālās nervu sistēmas traucējumiem, ņemot vērā tās galvenās enerģijas substrāta deficītu. Uz adrenerģijasimptomi ir: tahikardija, mydriasis; trauksme, agresivitāte; drebuļi, aukstā sviedri, parestēzija; Slikta dūša, spēcīga bada, hipersalizācija; Caureja, bagātīga urinācija. Uz neiroglikopēniskssimptomi ir astēnija,
samazinot uzmanības koncentrāciju, galvassāpes, bailes sajūtu, apjukumu, dezorientāciju, halucinācijas; Runas, vizuālās, uzvedības traucējumi, amnēzija, apziņas pārkāpums, krampji, pārejoša paralīze, kam. Skaidra atkarība no simptomu attīstības smaguma un secības, jo hipoglikēmija var nebūt. Var rasties tikai adrenerģiskie vai tikai neiroglikopēniskie simptomi. Dažos gadījumos, neskatoties uz Normoglikēmijas atjaunošanu un nepārtrauktu terapiju, pacienti var būt bīdāmās vai pat komūnas stāvoklī vairāku stundu un pat dienu laikā. Ilgstoša hipoglikēmija vai tās bieži epizodes var izraisīt neatgriezeniskas izmaiņas centrālajā nervu sistēmā (galvenokārt lielo puslodu garozā), kuru izpausmes ir ievērojami atšķirīgas no garšīgām un halucinējošām paranoīdām epizodēm līdz tipiskiem epilepsijas lēkumiem, kas ir Neizbēgams rezultāts, kas ir izturīgs demence.
Hiperglikēmija ir subjektīvi pārcelta uz pacientiem vieglāk nekā epizodes pat viegls hipoglikēmija. Tāpēc daudzi pacienti, kas saistīti ar bailēm par hipoglikēmiju, uzskata, ka ir nepieciešams saglabāt glikēmiju salīdzinoši augstā līmenī, kas faktiski atbilst slimības dekompensācijai. Šā stereotipa pārvarēšana prasa dažus ārstu un apmācības personāla centienus.
Diagnostika
Klīniskais attēls hipoglikēmijas pacientam ar SD kombinācijā ar laboratoriju (kā likums, ar glikozes mērītāju), kas atklāj zemu glikozes līmeni asinīs.
Diferenciāldiagnoze
Citi iemesli, kas izraisa apziņas zudumu. Ja SD pacienta apziņas zuduma cēlonis nav zināms, un nav iespējams veikt skaidru analīzi par glicēmijas līmeni, tas parāda glikozes ieviešanu. Bieži vien ir jānoskaidro biežas hipoglikēmijas attīstības cēloņi pacientiem ar SD. Visbiežāk tie ir nepietiekamas cukura terapijas un zema līmeņa pacienta zināšanas par to slimību. Jāatceras, ka, lai samazinātu cukura terapijas nepieciešamību, līdz tā pilnīga atcelšana ("pazuda SD") var radīt vairākas slimības (virsnieru mazspēja, hipotireoze, nieru un aknu mazspēja), tostarp ļaundabīgu audzēju.
Ārstēšana
Lai ārstētu vieglu hipoglikēmiju, kurā pacients apzinās un var palīdzēt sev, tas parasti ir pietiekami, lai ņemtu pārtiku vai šķidrumu, kas satur ogļhidrātus 1-2 maizes vienību daudzumā (10-20 g glikozes). Šāds numurs ir ietverts, piemēram, 200 ml saldo augļu sulas. Dzērieni efektīvāk pārtrauc hipoglikēmiju, jo šķidrā formā glikoze ir ievērojami uzsūcas. Ja simptomi turpina pieaugt, neskatoties uz ogļhidrātu turpināšanu, tas ir nepieciešams intravenozai glikozes vai intramuskulāra glikagona ievadīšanai. Tādā pašā veidā smaga hipoglikēmija tiek apstrādāta ar apziņas zudumu. Šādā gadījumā pacients tiek ieviests aptuveni 50 ml 40% glikozes šķīdums intravenozi.Glikozes ieviešana jāturpina līdz uzbrukuma saistīšanai un glicēmijas normalizācijai, lai gan lielāka deva ir līdz 100 ml un vairāk, kā noteikums nav nepieciešams. Glikagonstas tiek ieviests (kā noteikums, kas sagatavots rūpnīcas apstākļos, kas piepildīti ar šļirci) intramuskulāri vai subkutāni. Pēc dažām minūtēm glykēmijas līmenis glikoenolīzes glikagona indukcijas dēļ ir normalizēts. Tomēr tas ne vienmēr notiek: ar augstu insulīna līmeni asinīs glikagons ir neefektīvs. Gluagona pusperiods ir īsāks par insulīnu. Ar alkoholismu un aknu slimībām ir traucēta glikogēna sintēze, un glikagona ievadīšana var būt neefektīva. Glikagona lietošanas blakusparādība var būt vemšana, kas rada aspirācijas risku. Cieša pacienta vēlams pašu glikagona iesmidzināšanas tehniku.
Prognoze
Gaismas hipoglikēmija apmācītiem pacientiem, ņemot vērā labas slimības kompensācijas fona, ir droša. Bieža hipoglikēmija ir slikta SD kompensācijas zīme; Vairumā gadījumu šie pacienti pārējās dienas laikā dienā nosaka vairāk vai mazāk izteikta hiperglikēmija un augsta glilētā hemoglobīna līmeņa. Gados vecāki pacienti ar vēlu komplikācijām SD hipoglikēmija var izraisīt šādas asinsvadu komplikācijas kā miokarda infarkta, insults, tīklenes asiņošana. Hipoglikēmiskā koma ilgst līdz 30 minūtēm ar atbilstošu ārstēšanu un strauju atgriešanos apziņas, parasti nav nekādu komplikāciju un sekām.
7.8. Diabēta novēlotas komplikācijas
Vēlās komplikācijas attīstās ar abiem SD veidiem. Klīniski piešķir piecas galvenās novēlotas komplikācijas SD: makroangiopātija, nefropātija, retinopātija, neiropātija un diabēta kāju sindroms. Par vēlu komplikāciju nespecificitāte atsevišķiem veidiem SD nosaka fakts, ka viņu galvenā patogenētiskā saite ir hroniska hiperglikēmija. Šajā sakarā, brīdī izpausmes SD-1, novēlotas komplikācijas pacientiem gandrīz nekad neatbilst, attīstot gadu un gadu desmitus, atkarībā no efektivitātes terapijas. Lielākā klīniskā vērtība SD-1, kā likums, iegūst diabēta mikroangiopātija(neiropātija, retinopātija) un neiropātija (diabēta kāju sindroms). Ar SD-2, gluži pretēji, novēlotas komplikācijas bieži tiek konstatētas diagnozes laikā. Pirmkārt, tas ir saistīts ar to, ka SD-2 izpaužas ilgi pirms diagnozes izveidošanas. Otrkārt, ateroskleroze, klīniski izpaužas makroangiopātija, ir daudz patoģenēzes ar SD. Ar SD-2, lielāko klīnisko nozīmi, parasti iegūst cukura diabētu makroangiopātija,kas diagnozes laikā tiek konstatēts no lielākajiem pacientiem. Katrā konkrētajā gadījumā individuālo vēlu komplikāciju kopums un smagums atšķiras no viņu paradoksālas pilnīgas prombūtnes, neskatoties uz ievērojamu slimības ilgumu līdz visu iespējamo iespējām smagā formā.
Vēlās komplikācijas ir galvenais nāves cēlonispacienti ar SD un ņemot vērā viņa izplatību - vissvarīgākā medicīniskā un sociālā problēma vairumam valstu veselības aprūpes jomā. Par Ārstēšanas galvenais mērķisun novērojumi pacientiem ar CD ir profilakse (primāro, sekundāro, terciāro) tās novēlotas komplikācijas.
7.8.1. Diabēta makroangiopātija
Diabēta makroangiopātija- kolektīvs jēdziens, kas apvieno lielo artēriju aterosklerotisko bojājumu SD, \\ t
klīniski izpaužas kā išēmiskā sirds slimība (IBS), slīpi ateroskleroze smadzeņu kuģiem, zemākas ekstremitātes, iekšējās orgānus un arteriālo hipertensiju (7.16. Tabula).
Tabula. 7.16.Diabēta makroangiopātija
 Etioloģija un patogenēze
Etioloģija un patogenēze
Iespējams, līdzīgs etioloģijai un aterosklerozes patoģenēzei personām bez SD. Aterosklerotiskie plāksnes neatšķiras mikroskopiskā struktūrā indivīdiem no SD un bez tā. Tomēr ar SD uz priekšplāniem, var veikt papildu riska faktorus, vai SD saasina labi zināmus nespecifiskus faktorus. Tādējādi SD jāiekļauj:
1. Hiperglikēmija.Tas ir aterosklerozes riska faktors. HBA1C līmeņa pieaugums par 1% pacientiem ar SD-2 pieaugumu
risks, ka miokarda infarkta risks par 15%. Hiperglikēmijas aterogēnā rīcības mehānisms nav pilnīgi skaidrs, tas ir iespējams, ka tas ir saistīts ar LDL metabolisma gala produktiem un asinsvadu sienas kolagēna gala produktiem.
2. Artēriju hipertensija(AG). Patoģenēzē, liela nozīme ir pievienota nieru komponentam (diabēta nefropātija).AG ar SD-2 - ne mazāk nozīmīgu infarkta un insulta riska faktoru nekā hiperglikēmija.
3. Penselipidēmija.Hyperinsulamia, kas ir neatņemama insulīna rezistences komponents SD-2, izraisa HDL līmeni, palielinot triglicerīdu līmeni un blīvuma samazināšanos, t.i. Aterogēnās LDL stiprināšana.
4. Aptaukošanās,ar kuru lielākā daļa pacientu ar SD-2 cieš, ir neatkarīgs riska faktors ateroskleroze, miokarda infarkts un insults (skatīt 11.2 punktu).
5. Insulīna rezistence.Hyperinsulamia un augsta līmeņa insulīna-proinsulīna līdzīgu molekulu palielina aterosklerozes risku, kas var būt saistīta ar endotēlija disfunkciju.
6. Asins koagulācijas traucējumi.SD, fibrinogēna līmeņa pieaugums, trombocītu inhibitora aktivators un Willebrand faktors, kā rezultātā veidojas koagulētās asins sistēmas protrombotiskā stāvoklis.
7. Endotēlija disfunkcija,kas raksturīgs ar Plasminogēna inhibitoru un šūnu adhēzijas molekulu aktīvās aktivatora izpausmi.
8. Oksidējošs stressizraisot oksidēto LDL un F2-ISO-PERTS koncentrāciju.
9. Sistēmisks iekaisumskurā palielinās fibrinogēna un C-reaktīvā proteīna izpausme.
Nozīmīgākie faktori, kas paredzēti IWC riskam SD-2, ir paaugstināts ZBL līmenis, samazināts HDL, arteriālais hipertensija, hiperglikēmija un smēķēšana. Viena no aterosklerotiskās procesa atšķirībām SD ir biežāks un oklūzijas bojājuma distālais raksturs, \\ ttiem. Process biežāk iesaistās salīdzinoši mazākās artērijās, kas apgrūtina ķirurģisko ārstēšanu un pasliktina prognozi.
Epidemioloģija
Risks attīstīt IBS personām ar SD-2 6 reizes lielāks nekā bez diabēta, bet tas ir tas pats vīriešiem un sievietēm. Arteriāla hipertensija tiek konstatēta 20% pacientu ar SD-1 un 75% no SD-2. Kopumā pacientiem ar SD tas ir 2 reizes biežāk nekā bez viņa. Perifēro kuģu ateroskopiskais ateroskleroze attīstās 10% pacientu ar SD. Smadzeņu kuģu trombembolija attīstās 8% pacientu ar SD (2-4 reizes biežāk nekā bez SD).
Klīniskās izpausmes
Pārsvarā neatšķiras no tiem, kuriem nav SD. SD-2 makrovaskulāro komplikāciju klīniskajā priekšstatā (miokarda infarkts, insults, oklūzijas bojājums kāju kuģiem) bieži spēlē priekšplānā, un tas ir tieši pirmoreiz hiperglikēmija pacientam. Varbūt sakarā ar pievienoto autonomo neiropātiju līdz 30% no miokarda infarkta personām ar CD plūsmu bez tipiska angiosky uzbrukuma (biroulas infarkts).
Diagnostika
Aterosklerozes komplikāciju diagnostikas principi (IBS, smadzeņu ūdens traucējumi, kāju artēriju artēriju artēriju) principi neatšķiras no tiem indivīdiem bez SD. Mērs artēriju spiediens(AD) būtu jāveic katram pacientam ar SD ārstu un rādītāju definīciju lipīdu spektrsasinis (kopējais holesterīns, triglicerīdi, ZBL, HDL) pie SD jāveic vismaz reizi gadā.
Diferenciāldiagnoze
Citas sirds un asinsvadu slimības, simptomātiska artēriju hipertensija, sekundārā dlypidēmija.
Ārstēšana
♦ asinsspiediena kontrole.Pareizais sistoliskā asinsspiediena līmenis SD ir mazāks par 130 mmHg, un diastoliskais 80 mmng (7.3. Tabula). Lielākā daļa pacientu ir vajadzīgas vairākas hipotensīvas zāles, lai sasniegtu šo mērķi. Narkotikas hipotensīvās terapijas izvēlei CD ir AKE inhibitori un angiotenzīna receptoru blokatori, kas, ja nepieciešams, papildina tiazīda diurētiskie līdzekļi. Atlases preparāti pacientiem ar SDS, kas ir veikta miokarda infarkta, ir β-adrenoblays.
♦ DELLIPIDEMION KOREKCIJA.Tabulā tiek parādīti lipīdu spektra rādītāju mērķa līmeņi. 7.3. Hipolipidēmijas izvēles preparāti ir 3-hidroksi-3-metilglu-co-reduktāzes (statīnu) inhibitori (statīni).
♦ Antiagant terapija.Aspirin terapija (75-100 mg / dienā) ir pierādīts, ka pacientiem ar SD vecākiem par 40 gadiem ar paaugstinātu sirds un asinsvadu patoloģijas attīstības risku (apgrūtināta ģimenes vēsture, artēriju hipertensija, smēķēšana, dislipidēmija, mikroalbuminūrija), kā arī visiem pacientiem ar klīniskām izpausmēm aterosklerozes kā sekundāro profilaksi.
♦ IBS skrīnings un ārstēšana.IBB izslēgšanas testi ir pierādīti pacientiem ar sirds un asinsvadu slimību simptomiem, kā arī, nosakot patoloģiju EKG.
Prognoze
75% pacientu ar SD-2 un 35% pacientu ar SD-1 mirst no sirds un asinsvadu slimībām. Aptuveni 50% pacientu ar SD-2 mirst no CHD komplikācijām, 15% no smadzeņu trauka trombembolijas. Mirstība no miokarda infarkta personām ar SD pārsniedz 50%.
7.8.2. Diabēta retinopātija
Diabēta retinopātija(DR) - acs tīklenes mikroangiopātija, ko raksturo mikrovironmolies, asinsizplūdumu, eksudatīvo pārmaiņu un jaunizveidoto kuģu izplatīšanās, kas izraisa daļēju vai pilnīgu vīzijas zudumu (7.17. Tabula).
Etioloģija
Galvenais etioloģiskais faktors DR ir hroniska hiperglikēmija. Citi faktori (artēriju hipertensija, dyslipidēmija, smēķēšana, grūtniecība uc) ir mazāk svarīgas.
Patogenēze
DR patogenesis galvenās saites:
Tīkla kuģu mikroangiopātija, kas noved pie tādu kuģu uzraudzības sašaurināšanās, attīstot hipoperfūziju;
Kuģu deģenerācija ar mikrolīstības veidošanos;
Progresīva hipoksija, stimulējot kuģu izplatīšanu un ved uz tauku distrofiju un kalcija sāļu nogulsnēšanu tīklenē;
Tabula. 7.17.Diabēta retinopātija
 Mikroindarcts ar eksudāciju, kas noved pie mīkstu "kokvilnas plankumu" veidošanās;
Mikroindarcts ar eksudāciju, kas noved pie mīkstu "kokvilnas plankumu" veidošanās;
Lipīdu nogulsnēšanās ar blīvu eksudātu veidošanos;
Proliferējošo kuģu tīklenes izaugsme, lai veidotu shunts un aneurizmu, kas noved pie vēnu dilatācijas un tīklenes hipoperfūzijas pastiprināšanās;
Uzticēšanās fenomens ar tālāku išēmijas progresēšanu, kas ir infiltrātu un rētu veidošanās cēlonis;
Tīklenes atdalīšanās rezultātā tā išēmisko sabrukumu un veidošanos vitreoretinālie traktiem;
Hemorrhages stiklveida ķermenī, kā rezultātā hemorāģisko sirdslēkmes, masveida asinsvadu iebrukums un atsaužot aneurizmu;
IRIS kuģu proliferācija (diabēta rubļi), kas noved pie vidējās glaukomas attīstības;
Makulopātija ar pietūkumu pietūkumu.
Epidemioloģija
Cits ir visbiežāk sastopamais akluma iemesls attīstīto valstu iedzīvotāju vidū, un akluma attīstības risks pacientiem ar cukura diabētu 10-20 reizes lielāks nekā kopējā iedzīvotāju grupā. Diagnozes laikā SD-1, DR netiek konstatēts gandrīz kāds no pacientiem pēc 5 gadiem, slimība ir konstatēta 8% pacientu, un ar trīsdesmit gadu diabēta periodu - 98% no pacientiem. Diagnostikas laikā SD-2 Dr ir konstatēts 20-40% pacientu, un pacientiem ar piecpadsmit gadu pieredzi SD-2 - 85% apmērā. SD-1 proliferatīvā retinopātija rūpējas salīdzinoši biežāk un SD-2 - Maculopātijā (75% no Maculopātijas gadījumiem).
Klīniskās izpausmes
Saskaņā ar vispārpieņemto klasifikāciju, 3 izšķiršanas posmi
(7.18. Tabula).
Diagnostika
Pilnīga oftalmoloģiskā pārbaude, kas ietver tiešu oftalmoskopiju ar tīklenes fotografēšanu, tiek parādīts pacientiem ar SD-1 pēc 3-5 gadiem pēc slimības izpausmes, un pacientiem ar SD-2 tūlīt pēc tā atklāšanas. Nākotnē šādi pētījumi ir jāatkārto katru gadu.
Tabula. 7.18.Diabēta retinopātijas klasifikācija
 Diferenciāldiagnoze
Diferenciāldiagnoze
Cita acu slimība pacientiem ar diabētu.
Ārstēšana
Diabētiskās retinopātijas ārstēšanas pamatprincips, kā arī citas novēlotas komplikācijas ir optimāla kompensācija SD. Visefektīvākā metode ārstēšanas diabētiskās retinopātijas un novērstu aklumu ir lāzera fotokoagulācija.Mērķis
 Fig. 7.11.Diabēta retinopātija:
Fig. 7.11.Diabēta retinopātija:
a) nav proliferatīvs; b) prepolytematic; c) proliferatīvs
lāzera fotokoagulācija ir jaunizveidoto kuģu darbības pārtraukšana, kas ir galvenais drauds šādu smago komplikāciju attīstībai, piemēram, hemofthalm, tīklenes vilces tīklenes atdalīšanai, Iris berzes un sekundārā glaukoma.
Prognoze
Aklums tiek ierakstīts 2% pacientu ar CD (3-4% pacientu ar SD-1 un 1,5-2% pacientu ar SD-2). Aptuvenais biežums jauniem gadījumiem aklums, kas saistīts ar DR ir 3,3 gadījumi uz 100 000 iedzīvotāju gadā. SD-1 laikā HBA1C līdz 7,0% samazinājums rada draudu samazināšanos Dr attīstība par 75% un samazina progresēšanas risku par 60%. SD-2, HBA1C samazinājums par 1% noved pie samazināšanās Dr. attīstības riskam par 20%.
7.8.3. Diabēta nefropātija
Diabēta nefropātija(DNF) ir definēts kā albuminūrija (vairāk nekā 300 mg albumīna dienā vai olbaltumvielu vairāk nekā 0,5 g olbaltumvielu dienā) un / vai nieru filtrēšanas funkcijas samazināšanos indivīdos no CD, ja nav urīnceļu infekciju , sirds mazspēja vai citas nieru slimības. Mikroalbuminūrija ir definēta kā albumīna 30-300 mg / dienā vai 20-200 μg / min.
Etioloģija un patogenēze
Galvenie DNF riska faktori ir SD, hroniska hiperglikēmijas, artēriju hipertensijas, dyslipidēmijas, nieru slimība no vecākiem. Kad DNF galvenokārt ietekmē klastera aparatūranieres.
1. Viens no iespējamiem mehānismiem, par kuriem hiperglikēmijaveicina glomeru bojājuma attīstību, ir sorbīta uzkrāšanās, jo tiek aktivizēta glikozes metabolisma poliola ceļš, kā arī vairāki ierobežoti gyricēšanas produkti.
2. Hemodinamiskie pārkāpumi, proti, introLubok artērijas hipertensija(asinsspiediena paaugstināšana nieru glomiem) ir vissvarīgākais patogenesis komponents
Intraclude hipertensijas cēlonis ir arteriola tonis: beigu izbeigšana un sašaurināšanās beigām.
Tabula. 7.19.Diabēta nefropātija
 Tas, savukārt, notiek, ietekmē vairāku humorālo faktoru, piemēram, angiotenzīna-2 un endotelīnu, kā arī sakarā ar pārkāpumu elektrolītu īpašības bazālo membrānu glomeruli. Turklāt intrakalobiskā hipertensija veicina sistēmisko hipertensiju, ko nosaka vairums pacientu ar DNF. INTRACALOBIC hipertensijas dēļ ir bojājumi bazālajām membrānām un filtrēšanas porām, \\ t
Tas, savukārt, notiek, ietekmē vairāku humorālo faktoru, piemēram, angiotenzīna-2 un endotelīnu, kā arī sakarā ar pārkāpumu elektrolītu īpašības bazālo membrānu glomeruli. Turklāt intrakalobiskā hipertensija veicina sistēmisko hipertensiju, ko nosaka vairums pacientu ar DNF. INTRACALOBIC hipertensijas dēļ ir bojājumi bazālajām membrānām un filtrēšanas porām, \\ t
caur kuru dziesmas sāk iekļūt (mikroalbuminūrija), \\ tun tad ievērojamas summas albumīna (proteīnūrija).Bazālo membrānu sabiezējums izraisa to elektrolītu īpašību maiņu, kas pats par sevi rada lielāku albumīna daudzumu ultrafiltratē, pat ja nav mainījušās filtrācijas poru maiņas.
3. ģenētiskā nosliece.Pacientu ar DNF radiniekiem ar paaugstinātu frekvenci notiek artēriju hipertensija. Ir dati par DNF savienojumu ar AKE gēna polimorfismu. Mikroskopiski, DNF laikā, sabiezē bazālo membrānu glomers, paplašināšanās Mezanygia, kā arī šķiedru izmaiņas, kas rada un ilgst arteriolu tiek atklāti. Galīgajā posmā, kas klīniski atbilst hroniskai nieru mazspējai (CPN), tiek noteikts fokusa (kimmelistil-wilson), un pēc tam difūzā glomeroskleroze.
Epidemioloģija
Mikroalbuminūrija tiek noteikta 6-60% pacientu ar SD-1 5-15 gadiem pēc tās izpausmes. DNF nosaka par 35% no SD-1, biežāk vīriešiem un cilvēkiem, kuri ir izstrādājuši 15 gadu vecumā. SD-2, DNF attīstās 25% Eiropas sacensību pārstāvju un 50% Āzijas sacensību. DNF kopējā izplatība SD-2 ir 4-30%.
Klīniskās izpausmes
Salīdzinoši agrīna klīniskā izpausme, kas netieši saistīta ar DNF, ir arteriāla hipertensija. Citas klīniski skaidras izpausmes pieder vēlu. Tie ietver nefrotiskā sindroma un hroniskas nieru mazspējas izpausmes.
Diagnostika
Skrīnings DNF personām ar CD nozīmē ikgadējo testēšanu microalbuminuriaar SD-1 5 gadiem pēc slimības izpausmes un SD-2 tūlīt pēc tā atklāšanas. Turklāt, lai aprēķinātu vismaz ikgadēju kreatinīna līmeņa definīciju glomerulārās filtrēšanas ātrums (SCF).SCF var aprēķināt, izmantojot dažādus formulas, piemēram, ar Cocroft-Golta formulu:
Vīriešiem: a \u003d 1,23 (NOP SCF 100 - 150 ml / min) sievietēm: a \u003d 1,05 (SCF 85 - 130 ml / min)
DNF sākotnējos posmos var atklāt SCF pieaugumu, kas pakāpeniski samazinās kā CPN. Microalbuminūrija sāk noteikt 5-15 gadus pēc SD-1 izpausmes; Ar SD-2 8-10% gadījumu, tas ir atrodams tūlīt pēc tā konstatēšanas, iespējams, pateicoties ilgam asimptomātiskam slimības gaitai līdz diagnostikai. Proteinūrijas vai albuminūrijas attīstības maksimums SD-1 nokrīt no 15 līdz 20 gadiem pēc tās sākuma. Proteinūrija apliecina O. neatgriezeniskumsDNF, kas agrāk vai vēlāk noved pie CPN. Urēmija ir vidēji 7-10 gadus pēc skaidras proteīnūrijas izskata. Jāatzīmē, ka SCF nav korelē ar proteīnūriju.
Diferenciāldiagnoze
Citi proteīnūrijas cēloņi un nieru mazspēja indivīdiem no SD. Vairumā gadījumu DNF ir apvienota ar artēriju hipertensiju, diabētisko retinopātiju vai neiropātiju, ja nav, no kuriem diferenciāldiagnozi būtu īpaši rūpīgi. 10% gadījumu, ar SD-1 un 30% gadījumu SD-2 laikā proteīnūrija nav saistīta ar DNF.
Ārstēšana
♦ Galvenie nosacījumi primārā un sekundārā novēršana
DNF.ir kompensācija SD un saglabājot normālu sistēmisko asinsspiedienu. Turklāt DNF primārā profilakse nozīmē olbaltumvielu patēriņa samazināšanos - mazāk nekā 35% no ikdienas kalormateriālu.
♦ pie posmiem microalbuminuriaun proteinūrijapacientiem tiek parādīti AKE inhibitoru vai angiotenzīna receptoru bloķētāju iecelšana. Ar vienlaicīgu artēriju hipertensiju, tie ir paredzēti hipotensīvajās devās, ja nepieciešams, kopā ar citām hipotensīvām zālēm. Normālā artērijā šie medikamenti ir paredzēti devās, kas nerada hipotensijas attīstību. Gan AKE inhibitori (SD-1 un SD-2) un angiotenzīna receptoru blokatori (SD-2) veicina mikroalbuminūrijas pāreju uz proteinūriju. Dažos gadījumos, ņemot vērā šo terapiju, kombinācijā ar kompensāciju diabēta citiem parametriem, mikroalbuminūrija tiek likvidēta. Turklāt, sākot no mikroalbuminūrijas posma, tas ir nepieciešams
proteīnu patēriņa samazināšana ir mazāka par 10% no dienas kalorgiem (vai mazāk nekā 0,8 grami uz kg svara) un sāļi, kas ir mazāki par 3 gramiem dienā.
♦ skatuvē CPNparasti ir nepieciešama cukura terapijas korekcija. Lielākā daļa pacientu ar SD-2 ir jāpārvērš insulīna terapijā, jo TSP kumulācija veic smagu hipoglikēmijas risku. Lielākajai daļai pacientu ar SD-1 ir samazinājums insulīna nepieciešams, jo nieres ir viena no galvenajām vietām tās vielmaiņu. Palielinot kreatinīna seruma līmeni līdz 500 μmol / l un vairāk nepieciešams izvirzīt jautājumu par pacienta sagatavošanu ekstracorporural (hemodialīzes, peritoneālās dialīzes) vai ķirurģijas (nieru transplantācijas) ārstēšanas metode. Nieru transplantācija tiek parādīta kreatinīna līmenī līdz 600-700 μmol / l un samazina glomerulārās filtrācijas ātrumu, kas ir mazāka par 25 ml / min, hemodialīzi - 1000-1200 μmol / l un mazāk nekā 10 ml / min, attiecīgi.
Prognoze
50% pacientu ar SD-1 un 10% ar SD-2, kas atklāj proteīnūriju, CPN attīstās nākamo 10 gadu laikā. 15% no visiem pacientu nāves gadījumiem ar SD-1, kas jaunāki par 50 gadiem, ir saistīti ar CPN dēļ DNF.
7.8.4. Diabēta neiropātija
Diabēta neiropātija(DN) ir nervu sistēmas bojājumu sindromu kombinācija, ko var klasificēt atkarībā no izplatītās iesaistīšanās dažādo departamentu procesā (jutībā, autonomā), kā arī bojājuma izplatība un smagums (7.20. Tabula).
I. Sensomotor neiropātija:
Simetrisks;
Fokusa (mononereropātija) vai polifocal (galvaskausa, proksimālais motors, mononeroīdu ekstremitātes un torso).
II. Autonomā (veģetatīvā) neiropātija:
Sirds un asinsvadu (ortostatiskā hipotensija, sirds denervācijas sindroms);
Kuņģa-zarnu trakta (kuņģa atony, dyskinesia no žultsceļiem, diabēta enteropātija);
Uroģenitāli (ar urīnpūšļa funkcijām un seksuālo funkciju);
Pārkāpums pacienta spēja atpazīt hipoglikēmiju;
Skolēnu funkcijas pārkāpums;
Sviedru dziedzeru funkciju pārkāpums (distālā anhidroze, hiperhidroze, ēdot).
Tabula. 7.20.Diabēta neiropātija
 Etioloģija un patogenēze
Etioloģija un patogenēze
Galvenais dienas iemesls ir hiperglikēmija. Tiek pieņemts vairāki tās patoģenēzes mehānismi:
Glikozes metabolisma poliolo maršruta aktivizēšana, kā rezultātā nervu šūnās notiek sorbīts, fruktoze un mioindozes samazināšana un glutationme. Tas, savukārt, noved pie aktivizēšanas brīvo radikāļu procesus un samazinot slāpekļa oksīda līmeni;
Nervu šūnu ne-fermentatīvā glikozilēšana un citoplazmas olbaltumvielas;
Mikroangiopātija vasa Nactums,kas noved pie palēnināšanos kapilāru asins plūsmu un nervu hipoksiju.
Epidemioloģija
Izplatība Apakšā ar abiem SD veidiem ir aptuveni 30%. Ar SD-1 5 gadiem tas sāk konstatēt no 10% pacientu. SD-2 apakšas gadījumu biežums ir aptuveni 6% pacientu gadā. Visbiežāk iespēja ir distālā simetriskā jutīgā diena.
Klīniskās izpausmes
Sensomotor DN.izpaužas kā mehānisko un jutīgu traucējumu komplekss. Bieža distālās formas simptoms parestēzijakas izpaužas sevi ar sajūtu "pārmeklējot goosebumps", nejutīgums. Pacienti bieži sūdzas par pēdu galvu, lai gan tie paliek silti pieskārienu, kas ir zīme, kas ļauj atšķirt poleeeropātiju no išēmiskas izmaiņas, kad kājas uz pieskāriena ir aukstas. Agrīna sensoro neiropātijas izpausme ir vibrācijas jutīguma pārkāpums. Raksturojums ir "nemierīgais pēdu" sindroms, kas ir nakts parestēzijas un augstas jutības kombinācija. Sāpes kājāsbiežāk uztrauc naktī, kamēr dažreiz pacients var pacelties segas pieskārienu. Tipiskā sāpju gadījumā, pretēji tādām ar izvēršanas slimībām, artērijas var samazināties, staigājot. Pēc gadiem, sāpes var spontāni izbeigt sakarā ar nāves mazo nervu šķiedru, kas atbild par sāpju jutību. Hipoestēzijato izpaužas ar jutības zudumu pēc tipa "ganāmpulka" un "cimdi". Dziļā, propriRioceptīvā jutīguma pārkāpums noved pie koordinācijas pārkāpuma un kustības grūtības (maņu ataksija). Pacients sūdzas par "citām kājām", sajūtu "stāvot uz kokvilnas". Trophic inervācijas pārkāpums izraisa deģeneratīvas ādas, kaulu un cīpslu izmaiņas. Sāpju jutīguma pārkāpums rada biežus, ne ievērojamu pacientu ar pieturas mikrotrumammammu, kas ir viegli inficēti. KOORDINĀCIJAS UN DZĪVNIEKU VĒRTĒŠANA Vadiet ne-fizioloģisko pārdali slodzes uz kājas locītavām. Tā rezultātā tiek traucēta anatomiskas attiecības kāju legisting aparātos.
Pēdas arka ir deformēta, pietūkums, lūzumi, hroniski strutaini procesi (sk. 7.8.5. Punktu).
Vairākas autonomās dienas formas. Izraisīt sirds un asinsvadu forma- sirds un asinsvadu kompleksa un lielo kuģu inervācija. Klīstošais nervs ir garākais nervs, saistībā ar kuru tas ir pārsteigts pirms citiem. Simpātisku ietekmju pārsvarā attīstās tahcardia atpūta.Nepietiekama atbilde uz Orthostasis izpaužas pati ortostatiska hipotensijaun sinkopālās valstis. Plaušu kompleksa veģetatīvā denervācija noved pie sirds ritma mainīguma neesamības. Ar autonomo neiropātiju, palielināta izplatība starp pacientiem ar miokardi incecades SD ir saistīta.
Simptomi kuņģa-zarnu trakta formaDienas ir Gastroplaz ar lēnu vai, gluži pretēji, strauji tukša kuņģa, kas var radīt grūtības atlases insulīna terapijas, jo laika un apjoma iesūkšanas ogļhidrātu neskaidri atšķiras; Eshagus, refluksa-ezofagīta, disfāgija; Ūdens caureja. Priekš urogenital formaApakšējo daļu raksturo urīnpūšļa atonija, kas noved pie slīpuma uz urīnām infekcijām; Erekcijas disfunkcija (aptuveni 50% pacientu ar SD); Retrogrāda ejakulācija.
Citas iespējamās veģetatīvās dienas izpausmes - pārkāpums spēja atpazīt hipoglikēmiju, pārkāpjot skolēnu funkciju, sviedru dziedzeru funkciju pārkāpums (anhidroze), diabēta amyotrophyry.
Diagnostika
Katru gadu jāveic neiroloģiska pārbaude ar SD. Vismaz tas nozīmē testus, kuru mērķis ir identificēt distālo sensoru neiropātiju. Šim nolūkam tiek izmantota vibrācijas jutības aplēse, izmantojot šķiroto chateneton, taustes jutību ar monoformāciju, kā arī temperatūru un sāpju jutību. Saskaņā ar liecību, valsts veģetatīvās nervu sistēmas tiek pētīta: lai diagnosticētu nepietiekamību parasimpatisks sirds inervācija, vairāki funkcionālu paraugu tiek izmantoti, piemēram, mērīšanas sirdsdarbības ātrumu ar dziļu elpošanu ar novērtējumu mainīgumu
sirds ritms un paraugs valaltalva; Ortostatisku paraugu izmanto, lai diagnosticētu sirds simpātisko inervācijas nepietiekamību.
Diferenciāldiagnoze
Citu ģenēzes neiropātija (alkoholiskais, urems, ar 12 identisku anēmiju utt.). Viena vai otrā orgāna disfunkcijas diagnoze veģetatīvās neiropātijas rezultātā ir izveidota tikai pēc organiskās patoloģijas izslēgšanas.
Ārstēšana
1. Cukura terapijas optimizācija.
2. Rūpēties par kājām (sk 7.8.5 punktu).
3. Neirotropo narkotiku (α-lipoīnskābes) efektivitāte nav apstiprināta visos pētījumos.
4. Simptomātiska terapija (anestēzija, Siltenafils ar erekcijas disfunkciju, floccingisis ar ortostatisko hipotensiju utt.).
Prognoze
Sākotnējos posmos diena var būt atgriezeniska pret SD plaukta kompensācijas fonu. Apakšā nosaka 80% pacientu ar čūlainiem bojājumiem un ir galvenais riska faktoru amputācija
7.8.5. Diabēta pēdu sindroms
Diabēta pēdu sindroms(SDS) - pēdas patoloģiskā stāvokļa SD, kas rodas, ņemot vērā perifēro nervu, ādas un mīksto audu bojājumus, kaulus un savienojumus un izpaužas ar akūtiem un hroniskiem čūlas, kaulu locītavu bojājumiem un strutainiem procesiem ( 7.21. Tabula).
Etioloģija un patogenēze
SDS patoģenēze ir daudzveidīga, un to pārstāv neiropātisko un perfūzijas traucējumu kombinācija ar izteiktu tendenci uz infekciju. Pamatojoties uz viena vai otru uzskaitīto faktoru pārsvaru, 3 galvenās formas
Tabula. 7.21.Diabēta pēdu sindroms
 I neiropātiskā forma(60-70 %):
I neiropātiskā forma(60-70 %):
Bez osteoartropātijas;
Ar diabēta osteoartropātiju.
II. Neuriecemic (jaukta) forma(15-20 %).
III. Išēmiska forma(3-7 %).
SDS neiropātiskā forma. Diabēta neiropātijā visilgāko nervu distālie departamenti galvenokārt ietekmē. Ilgstošs trofisko impulsācijas deficīts izraisa ādas, kaulu, saišu, cīpslu un muskuļu hipotrofiju. Savienojuma konstrukciju hipotrofijas rezultāts ir pēdas deformācija ar atsauces slodzes nefizioloģisko pārdali un pārmērīgu atsevišķu zonu pieaugumu. Šajās vietās, piemēram, prognozēšanas galviņas kaklasaites kauliem, tiek atzīmēts ādas sabiezējums un veidošanās hiperkeratozes. Pastāvīgais spiediens uz šīm vietām noved pie līdzēto mīksto audu iekaisuma autolīzēm, kas rada priekšnoteikumus čūlainas defekta veidošanai. Atrofijas un traucējumu rezultātā āda kļūst sausa, tas ir viegli kreka. Sakarā ar sāpju jutības samazināšanu pacients bieži nepievērš uzmanību notikušajām izmaiņām. Tas nevar savlaicīgi atklāt neērtības kurpes, kas noved pie veidošanās Scuffs un kukurūzas, neievēro ieviešanu svešķermeņiem, mazu brūces vietās krekinga. Situācija pasliktina dziļas jutības traucējumus, kas izpaužas, pārkāpjot gaitu, nepareizu kadrus. Visbiežāk čūlainais defekts ir inficēts ar Staphylococci, Streptokoku, zarnu grupu baktērijām; Bieži pievienojas anaerobās floras. Neiropātiskā osteoartropātija ir smagu distrofisku izmaiņu rezultāts kājas (osteoporozes, osteolīzes, hiperostozes) bonestossert.
Išēmiska SDS veidlapa tā ir apakšējo ekstremitāšu artēriju aterosklerozes sekas, kas noved pie galvenās asins plūsmas pārkāpuma, t.I. Tas ir viens no diabēta makroangiopātijas variantiem.
Epidemioloģija
SDS novēro 10-25%, un saskaņā ar dažiem datiem vienā vai otrā veidā 30-80% pacientu ar diabētu. ASV, ikgadējie izdevumi par ārstēšanu pacientiem ar SD C CD ir 1 miljards dolāru.
Klīniskās izpausmes
Priekš neiropātiskā formaSDS piešķir divus biežākos bojājumus: neiropātiskā čūla un osteoartropātija (ar attīstību)
 Fig. 7.12.Neiropātisks čūla ar diabēta kāju sindromu
Fig. 7.12.Neiropātisks čūla ar diabēta kāju sindromu
 Fig. 7.13.Warcot savienojums ar diabētisko pēdu sindromu
Fig. 7.13.Warcot savienojums ar diabētisko pēdu sindromu
charco savienojums). Neiropātiskie čūlas,parasti lokalizēts reģionā vienīgo un starppaliktņu intervālu, t.e. Kāju sekcijās piedzīvo lielāko spiedienu (7.12. Att.).
Destruktīvas izmaiņas saistvielu kāju aparātu var progresēt vairāku mēnešu laikā un novest pie smagas kaulu deformācijas - diabēta osteo artropātijaun veidošanās charcot's locītavatajā pašā laikā pēdas formāli ir formāli, salīdzinot ar "soma ar kauliem"
Priekš sDSķīmiskā forma
Āda kājām ir auksta, gaiša vai cianotiska; Mazāk bieži ir rozā sarkanā ēna par virspusēju kapilāru paplašināšanos, reaģējot uz išēmiju. Čūlaini defekti rodas atkarībā no akrālās nekrozes veida - uz pirkstu galiem, papēžu malas virsma (7.14. Att.).
Pulse artērijās kāju, popliteal un augšstilba artērijas ir vājināta vai nav acīmredzama.
Tipiski gadījumos pacienti uzliek sūdzības "krustojošai hroma". Ekspīnijas išēmisko bojājumu smagumu nosaka trīs galvenie faktori: stenozes smagums, nodrošinājuma asins plūsmas attīstība, asiņu koagulācijas sistēmas stāvoklis.
Diagnostika
SD pacienta kāju pārbaude jāveic katru reizi apmeklējot ārstu, ne retāk kā reizi pusgadā. SDS diagnostika ietver:
 Fig. 7.14.Acrral nekroze ar diabētiskās pēdu sindroma išēmisko formu
Fig. 7.14.Acrral nekroze ar diabētiskās pēdu sindroma išēmisko formu
Kāju pārbaude;
Neiroloģiskā stāvokļa novērtēšana - dažādi jutīguma veidi, cīpslu refleksi, elektromogrāfija;
Artēriju asins plūsmas stāvokļa novērtēšana - angiogrāfija, doplerometrija, doplerogrāfija;
Stop un potītes locītavu rentgena;
Bakterioloģiskā izpēte brūču izlādes.
Diferenciāldiagnoze
Tas tiek veikts ar brūces procesiem cita ģenēzes pēdās, kā arī citas okluzīvas slimības apakšējo ekstremitāšu kuģiem un pēdu locītavu patoloģiju. Turklāt SDS klīniskajām formām jābūt diferencētām (7.22. Tabula).
Ārstēšana
Ārstēšana neiropātisks inficētssDS veidlapas ietver kompleksu šādiem notikumiem:
CD kompensācijas optimizācija parasti palielinās insulīna devas un ar SD-2 - nodošanu uz to;
Sistēmiskā antibiotiku terapija;
Pilna izkraušana kājām (tas var izraisīt dzīšanu čūlas dažu nedēļu laikā);
Vieta brūču apstrāde ar hiperkeratozes sekciju noņemšanu;
Rūpes par kājām, pareizu izvēli un īpašu apavu izmantošanu. Savlaicīga konservatīva terapija ļauj
izvairieties no operatīvās iejaukšanās 95% gadījumu.
Tabula. 7.22.Klīnisko SDS formu diferenciālā diagnoze
 Ārstēšana išēmiskssDS veidlapas ietver:
Ārstēšana išēmiskssDS veidlapas ietver:
CD kompensācijas optimizācija parasti palielinās insulīna devas un ar SD-2 - nodošanu uz to;
Ja nav čūlu necrotisku bojājumu, ergoterapija (1-2 stundu pastaigas dienā, kas veicina nodrošinājuma asins plūsmas attīstību);
Revaskularizācijas operācijas skartajos kuģos;
Konservatīvā terapija: antikoagulanti, aspirīns (līdz 100 mg / dienā), ja nepieciešams - fibrinolitics, prostaglandīna preparāti un prostaciklīns.
Attīstoties plašiem strutainiem necaurļveida bojājumiem, ar visiem VDS variantiem, amputācija ir paaugstināta.
Prognoze
No 50 līdz 70% no kopējā kāju maisīšanas skaita veido pacienti ar diabētu. Pēdu amputācija pacientiem ar SD tiek ražoti 20-40 reizes biežāk nekā tie bez diabēta.
7.9. Cukura diabēts un grūtniecība
Gestācijas diabēts(GSD) ir glikozes tolerances pārkāpums, pirmo reizi atklājās grūtniecības laikā (7.23. Tabula). Šī definīcija neizslēdz, ka ogļhidrātu apmaiņas patoloģija varētu būt pirms grūtniecības sākuma. GHS būtu jānošķir no situācijām, kad sieviete ar diagnosticētu diabētu (pēc vecuma, biežāk nekā SD-1) ir grūtniecība.
Etioloģija un patogenēze
GES ir līdzīgs SD-2. Augsts olnīcu un placentas steroīdu līmenis, kā arī virsnieru garozas kortizola veidošanās pieaugums grūtniecības laikā attīstīt fizioloģisko insulīna rezistenci. DVS izstrāde ir saistīta ar faktu, ka insulīna rezistence, protams attīstīties grūtniecības laikā, un tāpēc paaugstināta nepieciešamība pēc insulīna predisponētās personas pārsniedz funkcionālo spēju β-šūnu PJZ. Pēc piegādes ar hormonālo un vielmaiņas attiecību atgriešanu līdz sākotnējam līmenim tas parasti iet.
Tabula. 7.23.Gestācijas diabēts
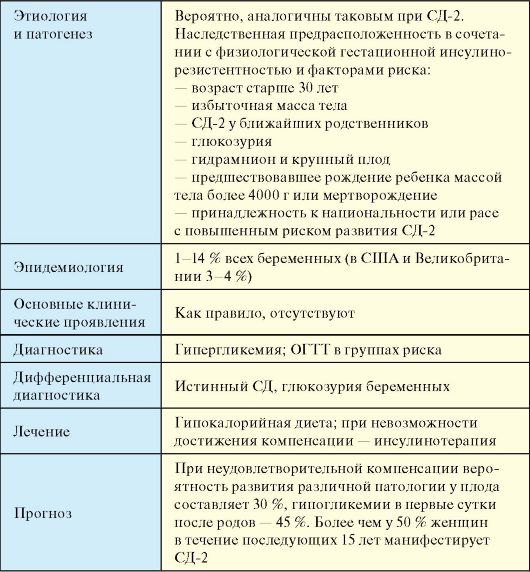 GSD parasti attīstās vidū 2 trimestrī, no 4 līdz 8 grūtniecības mēnešiem. Lielākā daļa pacientu ir liekā ķermeņa svara un ae apgrūtinātā vēsture. GDG riska faktori, kā arī sieviešu grupas ar zemu attīstības DVS risku, tiek parādīti tabulā. 7.24.
GSD parasti attīstās vidū 2 trimestrī, no 4 līdz 8 grūtniecības mēnešiem. Lielākā daļa pacientu ir liekā ķermeņa svara un ae apgrūtinātā vēsture. GDG riska faktori, kā arī sieviešu grupas ar zemu attīstības DVS risku, tiek parādīti tabulā. 7.24.
Tabula. 7.24.Riska faktori attīstībai gestācijas diabēta
 Māte hiperglikēmija izraisa hiperglikēmiju bērna asinsrites sistēmā. Glikoze viegli iekļūst placentā un nepārtraukti pārvietojas uz mātes asinīm augļiem. Aktīva transporta aminoskābju un ketona korpusu pārneses arī notiek. Atšķirībā no šī insulīna, glikagona un brīvās taukskābes mātes asinīs augļa neietilpst. Pirmajās 9-12 grūtniecības nedēļās PJZ Fetal vēl nav ražojis savu insulīnu. Šoreiz atbilst augļa organogenēzes fāzei, kad dažādas attīstības formalitātes (sirds, mugurkaula, muguras smadzeņu, gastroy) var veidoties mātes pastāvīgajā hiperglikēmijā. Kopš grūtniecības 12 nedēļu PJZ Fetal sāk sintezēt insulīnu, un, reaģējot uz hiperglikēmiju, reaktīvo hipertrofiju un augļa pjz β-šūnu hiperplāziju. Pateicoties hiperinsulinmijai, augļa makro attīstās, kā arī lecitīna sintēzes apspiešana, kas izskaidro elpošanas traucējumu augsto frekvenci jaundzimušajiem. Tā kā β-šūnu un hiperinsulinmijas hiperplāzijas rezultātā parādās tendence uz smago un ilgu hipoglikēmiju.
Māte hiperglikēmija izraisa hiperglikēmiju bērna asinsrites sistēmā. Glikoze viegli iekļūst placentā un nepārtraukti pārvietojas uz mātes asinīm augļiem. Aktīva transporta aminoskābju un ketona korpusu pārneses arī notiek. Atšķirībā no šī insulīna, glikagona un brīvās taukskābes mātes asinīs augļa neietilpst. Pirmajās 9-12 grūtniecības nedēļās PJZ Fetal vēl nav ražojis savu insulīnu. Šoreiz atbilst augļa organogenēzes fāzei, kad dažādas attīstības formalitātes (sirds, mugurkaula, muguras smadzeņu, gastroy) var veidoties mātes pastāvīgajā hiperglikēmijā. Kopš grūtniecības 12 nedēļu PJZ Fetal sāk sintezēt insulīnu, un, reaģējot uz hiperglikēmiju, reaktīvo hipertrofiju un augļa pjz β-šūnu hiperplāziju. Pateicoties hiperinsulinmijai, augļa makro attīstās, kā arī lecitīna sintēzes apspiešana, kas izskaidro elpošanas traucējumu augsto frekvenci jaundzimušajiem. Tā kā β-šūnu un hiperinsulinmijas hiperplāzijas rezultātā parādās tendence uz smago un ilgu hipoglikēmiju.
Epidemioloģija
CD cieš no 0,3% no visām reproduktīvās vecuma sievietēm, 0.2-0.3% no grūtniecēm jau ir sākotnēji slims, un 1-14% grūtniecību GSD izstrādā vai izpaužas patiesā SD. SDS izplatība dažādās populācijās atšķiras, tāpēc ASV tiek konstatēts aptuveni 4% grūtniecēm (135 tūkstoši lietu gadā).
Klīniskās izpausmes
Trūkst GPS. Var būt nespecifiski simptomi, kas dekompensācija SD.
Diagnostika
Noteikt glikozes līmeni tukšā dūšā ir redzams visām grūtniecēm bioķīmiskā asins analīzē. Sievietes, kas pieder riska grupai (7.24. Tabula), rāda mutes glikozes tests(OGTT). Ir daudzas iespējas grūtniecēm. Vieglākais no tiem nozīmē šādus noteikumus:
3 dienas pirms pārbaudes, sieviete ir parastā uzturs un ievēro parasto fizisko aktivitāti;
Tests tiek veikts no rīta tukšā dūšā, pēc nakts bada vismaz 8 stundas;
Pēc asins parauga lietošanas tukša kuņģa sieviete dzer šķīdumu 5 minūtes, kas sastāv no 75 gramiem sausas glikozes, kas izšķīdina 250-300 ml ūdens; Glikēmijas līmeņa atkārtota noteikšana pēc 2 stundām.
GSD diagnoze ir iestatīta uz šādu informāciju kritēriji:
Glikozes cietā asins (venoza, kapilārā) tukšā dūša\u003e 6.1 mmol / l vai
Glikozes plazma no venozas asinīm ≥ 7 mmol / l vai
Glikozes cietā kapilārā asins vai venozo asins plazmā 2 stundas pēc slodzes 75 g glikozes ≥ 7,8 mmol / l.
Ja sieviete, kas pieder riska grupai, pētījuma rezultāti atbilst normai, tests tiek atkārtoti izmantots 24-28 grūtniecības nedēļā.
Diferenciāldiagnoze
GSD un patiess sd; Grūtnieču glikozūrija.
Ārstēšana
Risks mātei un auglim, kā arī pieejas ārstēšanai SD un funkcijas kontroles pār to ar GDG un ar patieso SD ir vienādi. SD vēlu komplikācijas grūtniecības laikā var ievērojami attīstīties, bet ar augstas kvalitātes kompensāciju par SD indikācijām grūtniecības pārtraukšanai. Sieviete, kas cieš no SD (kā likums, mēs runājam par SD-1), vajadzētu plānot grūtniecību jaunībā, kad zemākās komplikācijas risks. Ja ir plānota grūtniecība, ir ieteicams atcelt kontaktu
dažus mēnešus pēc optimālas kompensācijas sasniegšanas. Kontrindikācijas grūtniecības plānošanai ir smaga nefropātija ar progresīvu nieru mazspēju, smagiem kompaktdiskiem, smagu proliferatīvu retinopātiju, kas nav korekcijas, ketoacidoze grūtniecības sākumā (ketona ķermeņi ir teratogēni faktori).
Ārstēšanas mērķisGSD un True SD grūtniecības laikā ir šādu laboratorijas rādītāju sasniegšana:
Spool glikēmija< 5-5,8 ммоль/л;
Glikēmija 1 stunda pēc ēšanas< 7,8 ммоль/л;
Glikēmija 2 stundas pēc ēšanas< 6,7 ммоль/л;
Vidējā vērtība ikdienas glikēmijas profila< 5,5 ммоль/л;
HBA1C līmenis ar ikmēneša uzraudzību, piemēram, veselīgi (4-6%).
Ar SD-1, kā ārpus grūtniecības, sievietei jāsaņem intensīva insulīna terapija, bet glycēmijas līmenis grūtniecības laikā ieteicams novērtēt 7-8 reizes dienā. Ja nav iespējams sasniegt normoglikēmijas kompensāciju, ņemot vērā parastās injekcijas, ir jāapsver pacienta tulkojums insulīna terapijai, izmantojot insulīna dozatoru.
Pirmajā posmā gSD ārstēšanadiēta terapija tiek piešķirta, kas sastāv no ikdienas kalorganizācijas ierobežošanu aptuveni 25 kcal / kg faktiskā svara, galvenokārt sakarā ar vienkāršāko ogļhidrātu un dzīvnieku taukiem, kā arī fiziskās slodzes paplašināšanu. Ja pret fona uztura terapiju, nav iespējams sasniegt ārstēšanas mērķus, pacientam ir jāpiešķir intensīva insulīna terapija. Jebkuras tableted cukura zāles (tējk) grūtniecības laikā kontrindicēts.Insulīna terapija izrādās nepieciešams tulkot aptuveni 15% sieviešu.
Prognoze
Ar neapmierinošu kompensāciju DV un SD grūtniecības laikā, iespējamība dažādu patoloģiju auglim ir 30% (risks ir 12 reizes lielāks nekā kopējā populācijā). Vairāk nekā 50% sieviešu, kas grūtniecības laikā, GDS tika konstatēts, nākamajiem 15 gadiem, manifests SD-2.
Daudzu slimību profilaksē ar iedzimtu predispozīciju, uz kuru EAF ir vajadzīgā saitemedicīnas un ģenētiskās konsultācijas. Galvenais uzdevums medicīnas un ģenētiskās konsultācijas ir noteikt ģenētisko risku slimības un izskaidrot tās nozīmi par pieņemamu formā. Kad SD uz medicīnisko un ģenētisko konsultāciju, laulātie visbiežāk ir atkarīgi novērtēt risku slimības nākotnes bērniem, jo \u200b\u200bklātbūtni šo slimību iepriekšējos bērniem, vai starp laulātajiem pašiem un / vai viņu radiniekiem.Iedzīvotāju-ģenētiskie pētījumi ļāva aprēķināt to Ģenētisko faktoru ieguldījums SD attīstībā arliek 60-80%. Šajā sakarā sākotnējā nozīme un nākotne iegūst pacientu ar SD radinieku medicīnisko un ģenētisko konsultāciju.
Galvenie jautājumi, ar kuriem jums parasti ir jāsaskaras ar ārstu, attiecas uz risku attīstīt SD ir vairāk bērnu vai brāļu māsupacients, spēja to klasificēt arī prognoze titoturpmāko (plānoto) ģimenes locekļu (plānoto) ģimenes locekļu summēšana.
Konsultācijas ģimenēm pacientiem ar pacientiem ar 1. tipa tipa pacientiem sastāv no vairākiem vispārpieņemtiem posmiem, kuriem ir savas īpašības šajā kontingentā.
11.1. Konsultāciju posmi
Pirmais konsultāciju posms - slimības diagnozes kopsavilkums.
Parasti 1. tipa diabēta diabēta diagnoze bērnu un jaunības vecumā nav grūtības. Tomēr SD klātbūtnē citiem ģimenes locekļiem ir nepieciešama diabēta veida pārbaude, kas dažos gadījumos var būt grūts uzdevums, un tas prasīs ārstam rūpīgi savākt pacienta relatīvo anamnēzi. Diferenciāldiagnoze starp diviem galvenajiem veidiem SD (1 un 2) tiek veikta saskaņā ar vispārpieņemtiem kritērijiem.
Pierādīts ar iedzīvotāju-ģenētisko pētījumu ģenētiskā neviendabība divu galveno veidu SD liecina par viņu nosolisko neatkarību un neatkarību mantojuma. Tas nozīmē, ka tie, kas pieejami ciltsrakstī pacientiem ar CD 2 veidiem, ir nejauši, un to nedrīkst ņemt vērā, novērtējot ģimenes risku.
Veicot medicīnisko un ģenētisko konsultāciju, ir nepieciešams arī izslēgt ģenētiskos sindromus, kas ietver cukura diabētu, jo tos raksturo monogēnu mantojums.
Otrais konsultāciju posms - Slimību attīstības riska noteikšana attiecībā uz pieejamajiem ģimenes locekļiem un plānotajiem pēcnācējiem.
Empīriskās metodes ieguva vidējais diabēta riska novērtējums ģimeņu locekļiem ar radiniekiem ar 1. tipa SD. Maksimālais risks ir radinieki no i radniecības (bērniem, vecākiem, māsas brāļiem) - vidēji no 2,5-3% līdz 5-6%. Ir konstatēts, ka diabēta slimības biežums bērni no tēviem ar SD 1 tipu 1 -2% augstākanekā no mātēm ar 1. tipa tipu.
Katrā konkrētajā ģimenē slimības attīstības risks ir atkarīgs no daudziem faktoriem: pacientu skaits un veselīgie radinieki, diabēta izpausmes vecums ģimenes locekļos, apspriešanās ar vecumu utt.
8. tabula.
Empīriskais risks pacientu radiniekiem SD tips 1
Uz īpašu tehniku \u200b\u200baprēķina riska tabulu izstrādeSD 1. Ierakstiet atkarībā no pacientu skaita un veseliem radiniekiem un pēc apspriešanās ar vecumu priekš dažādu veidu ģimenēm. Ģimenes, vecāku statuss un pacientu ar SIB ir parādīti 9. tabulā.
Dauna sindroms nav slimība, šī patoloģija nav iespējama, lai novērstu un izārstētu. Auglim ar leju sindromu 21. pārī hromosomu ir trešais papildu hromosomu, kā rezultātā to summa nav 46, bet 47. Dauna sindroms ir vērojams vienā no 600-1000 jaundzimušajiem no sievietēm vecumā pēc 35 gadiem. Iemesls, kāpēc tas notiek, tas nav pilnībā izskaidrots. Ārsts no Anglijas John Langdon uz leju vispirms aprakstīja šo sindromu 1866. gadā, un 1959. gadā Francijas profesors Lezhens pierādīja, ka tas ir saistīts ar ģenētiskām izmaiņām.
Ir zināms, ka pusi hromosomu bērni nokļūst no mātes, un puse - no Tēva. Tā kā nav vienota efektīva metode, lai ārstētu sindromu, slimība tiek uzskatīta par neārstējamu, jūs varat veikt pasākumus, un, ja jūs vēlaties, lai dzemdētu bērnu veselīgu, sazinieties ar medicīnisko un ģenētisko padomu, kur, pamatojoties uz hromosomu Analīze, vecāki tiks noteikti, bērns būs dzimis veselīgs vai ar Dauna sindromu.
Nesen šie bērni piedzimst biežāk, viņi to saistās ar novēlotu laulību, ar grūtniecības plānošanu vecumā no 40 gadiem. Tiek arī uzskatīts, ka, ja vecmāmiņa dzemdēja viņas meitu pēc 35, tad mazbērni var piedzimt ar Dauna sindromu. Lai gan pirmsdzemdību diagnoze ir sarežģīts apsekojuma process, tā īstenošana ir ļoti nepieciešama, lai varētu pārtraukt grūtniecību.
Kas ir Dauna sindroms. To parasti var papildināt ar mehānisko attīstību. Šādiem bērniem ir iedzimtas sirds defekti, kuņģa-zarnu trakta attīstības patoloģija. 8% pacientu ar Dauna sindromu ir slims leikēmija. Ārstēšana var stimulēt garīgo aktivitāti, normalizē hormonālo nelīdzsvarotību. Izmantojot fizioterapijas procedūras, masāžas, terapeitisko vingrošanu, jūs varat palīdzēt bērnam apgūt pašapkalpošanās prasmes. Dauna sindroms ir saistīts ar ģenētisko pārkāpumu, bet ne vienmēr noved pie bērna fiziskās un garīgās attīstības pārkāpuma. Šādi bērni un nākotnes pieaugušie var piedalīties visās dzīves jomās, daži no tiem kļūst par aktieriem, sportistiem un var iesaistīties sabiedriskajās lietās. Kā cilvēks attīstīsies ar šo diagnozi, lielā mērā ir atkarīga no vides, kurā tas aug. Labi apstākļi, mīlestība un aprūpe veicina pilntiesīgu attīstību.
Dowon sindroma riska tabula pēc vecuma
Dauna sindroma varbūtība ir atkarīga no mātes vecuma, bet to var atklāt ar ģenētisko pārbaudi grūtniecības sākumposmā, un dažos gadījumos ultraskaņu. Varbūtība, ka bērna uz leju sindroms dzimšanas ir zemāka nekā agrākos grūtniecības posmos, jo Daži augļi ar Dauna sindromu neizdzīvo.

Kāds risks tiek uzskatīts par zemu, un kas ir augsts?
Izraēlā risks, ka sindroms tiek uzskatīts par augstu, ja tas ir lielāks par 1: 380 (0,26%). Ikvienam, kas atrodas šajā riska grupā, ir jāpārbauda ar iekĜautiem ūdeņiem. Šis risks ir vienāds ar risku tām sievietēm, kas ir grūtnieces 35 gadu vecumā.
Risks ir mazāks par 1: 380 tiek uzskatīts par zemu.
Bet ir jāpatur prātā, ka šīs robežas var peldēt! Piemēram, Anglijā augstais riska līmenis tiek uzskatīts par augstāks par 1: 200 (0,5%). Tas ir saistīts ar to, ka dažas sievietes uzskata, ka risks ir 1 līdz 1000 - augsts, un otrs no 1 līdz 100 - zems, jo ar šādu risku viņiem ir iespēja dzimtene veselīga bērna vienāds ar 99%.
Riska faktori nosaka sindromu, Edwards, Patau
Galvenie riska faktori ir vecums (īpaši būtiski uz leju sindromu), kā arī radiācijas ietekmi, daži smagie metāli. Jāatceras, ka pat bez riska faktoriem augļiem var būt patoloģija.
Kā redzams no grafika, atkarība no riska riska no vecuma ir nozīmīgākais uz leju sindromu, un mazāk nozīmīga divām citām trisomy:

Dauna sindroma skrīninga risks
Līdz šim visas grūtnieces, papildus paļaušanās analīzēm, ieteicams iziet pārbaudes testu, lai noteiktu riska pakāpi uz leju sindromu, dzimšanas bērna un iedzimtu augļa vices. Visproduktīvākā aptauja notiek 11 nedēļās + 1 dienā vai 13 nedēļā + 6 dienas ar embrija kokcikas tumsu no 45 mm līdz 84 mm. Grūtniece var iziet apsekojumu un izmantot konkrētu ultraskaņu.
Precīzāka diagnoze tiek veikta, izmantojot horiona stikla biopsiju un amnija šķidruma izpēti, kas ir slēgta, izmantojot īpašu adatu tieši no augļu burbuļa. Bet katrai sievietei ir jāzina, ka šādas metodes ir konjugāts ar risku, grūtniecības komplikācijas, piemēram, aborts, augļa infekcija, dzirdes zuduma attīstība bērnam un daudz ko citu.
Pilnīga kombinētā skrīnings I - II trimestrī grūtniecības ļauj identificēt iedzimtas malforms pie augļa. Kas ietver šo testu? Pirmkārt, ultraskaņas pētījums ir nepieciešams 10-13 grūtniecības nedēļās. Riska aprēķins tiek veikts, lai noteiktu deguna kaula klātbūtni, augļa dzemdes kakla platumu, kur zemādas šķidrums uzkrājas pirmajā grūtniecības trim.
Sekunrakstā asins analīzes tiek ņemta uz horionu gonadotropin 10-13 nedēļās un Alpha fetoprotein 16-18 nedēļu laikā. Kombinētās pārbaudes datus apstrādā īpaša datorprogramma. Zinātnieki ierosināja jaunu skrīninga metodiku - apvienojot pētījumos iegūto rezultātu novērtējumu pirmajā un otrajā trimestrī. Tas ļauj mums nodrošināt vienotu riska novērtējumu par rašanos uz leju sindromu grūtniecības laikā.
Pirmajā trimestrī tiek izmantoti RRR noteikšanas rezultāti un tiek izmantoti apkakles telpas biezuma mērīšanas rezultāti, kā arī otrajam trimestrim - izmanto AFP, kas nav konjugētu estriols, XG un inhibin-A izmanto. Integrēta novērtējuma izmantošana pārbaudes aptaujas ļauj pēc invazīvām iejaukšanās, lai samazinātu biežumu pārtraukt grūtniecību augļiem ar normālu kariotipu saskaņā ar citoģenētiskās diagnostikas rezultātiem.
Integrāla un bioķīmiskā pārbaude, lai pārbaudītu sindromu, ļauj vēl vairāk noteikt vairākus hromosomu anomāliju gadījumus. Tas veicina nevēlamu grūtniecības pārtraukumu novēršanu, kas izriet no amnioocentes vai biopsijas vorsīna koridijas.
Ekspertu redaktors: Mochalova Pavel Aleksandrovich | d. n. terapeits
Izglītība: Maskavas Medicīnas institūts. I. M. Sechenovs, specialitāte - "Terapeitiskais korpuss" 1991. gadā, 1993. gadā "Profesionālās slimības", 1996. gadā "Terapija".
Diabēta ģenētika
1. tipa SD 1 prognoze augsta riska grupās
T.V.Nikonova, I.I. Vectēvs, ji.p. Alekseevs, M.N. Boldyreva, O.M. Smirnova, I.V. Dubinkin *.
Endokrinoloģiskais zinātniskais centrs i (brieži. - Acad. Ramn I. I. DEVOV) Ramna, i * SSC "Imunoloģijas institūts" I (brieži. - Acad. Krievijas Federācija, Maskava) M3. Es
Pašlaik ir palielinājies SD 1 tipa biežums visā pasaulē. Tas ir saistīts ar vairākiem faktoriem, tostarp pacientu ar diabēta paredzamā dzīves ilguma pieaugumu diagnostikas un terapeitiskās palīdzības uzlabošanai, uzlabota auglība un vides situāciju pasliktināšanās. Samazināt SD sastopamību var veikt ar preventīviem pasākumiem, prognozēt un novērst slimības attīstību.
Spriegošana SD 1 tipam ir ģenētiski noteikts. 1. tipa 1. tipa sastopamību kontrolē vairāki gēni: insulīna gēns uz hromosoma 11p15.5 (Yuom2), gēnu uz hromosomas c \\\\ c (yuom4), 6t (yuom5). Vislielākā nozīme no zināmajiem ģenētiskajiem marķieriem 1. tipa 1. tipa ir Gēni NAA reģiona uz hromosomu 6P 21.3 (Sew1); Līdz 40% no ģenētiskās nosliece uz SD 1 tipu ir saistīti ar tiem. Neviena cita ģenētiskā zona nosaka risku saslimt ar slimību, kas ir salīdzināma ar na.
Augsts 1 tipa tipa attīstības risks nosaka alēles varianti kodolgēniem: 1. decembris * 03, * 04; OOA1 * 0501, * 0301, OOB1 * 0201, * 0302. 95% pacientu ar 1 tipu SD ir AMA * 3 vai 011 * 4 antigēnas, un no 55 līdz 60% ir abi antigēna. Allel Oob1 * 0602 reti sastopams ar 1. tipa veidu un tiek uzskatīts par protestu.
Klīniskās izpausmes diabēta ir pirms latentā perioda, ko raksturo klātbūtne salu mobilo imunitātes marķieri; Šie marķieri ir saistīti ar progresīvu iznīcināšanu.
Tādējādi ģimenes locekļiem ar iepriekšējiem SD 1 tipa slimības gadījumiem ir īpaši svarīga slimību prognoze.
Šī darba mērķis bija veidošanās augsta riska tipa attīstības grupu Krievijas iedzīvotāju skaits Maskavas iedzīvotāju, pamatojoties uz pētījumu ģenētisko, imunoloģisko un vielmaiņas marķieri diabēta, izmantojot ģimenes pieeju.
Materiāli un pētniecības metodes
Aptaujāti 26 ģimenes, kurās viens no vecākiem slimo 1 tipa SD 1, no kuriem 5 ir "kodolieroči" ģimenes (tikai 101 cilvēki). Aptaujāto ģimenes locekļu skaits svārstījās no 3 līdz 10 cilvēkiem. Pacienti SD 1 Tēvu tips - 13, pacienti ar Mat 1 veida mātēm ir arī 13. Ģimenes, kurās abi vecāki būtu slims 1 tipa, tur nebija.
Aptaujāti 37 pēcnācēji pacientiem ar SD 1 tipu bez klīniskām izpausmēm slimības, no kuriem 16 -gen-ģints, 21 ir vīrietis. Pārbaudīto pēcteču vecums svārstījās no 5 līdz 30 gadiem. Pārbaudīto pēcnācēju sadalījums pa vecumu ir iesniegts tabulā. viens.
1. tabula
Aptaujāto bērnu vecums (pēcnācēji)
Vecuma (gadi) numurs
Ģimenēs ar pacientiem ar SD mātēm tika pārbaudīti 17 bērni (8 meitenes, 9 zēni) ģimenēs ar pacientiem ar diabēta tēviem - 20 bērni (8 meitenes, 12 zēni).
AutoAndile aģents (3-šūnas (ICA) tika noteikta divos veidos: 1) par Cilvēka I (0) asins grupu aizkuņģa dziedzera kreklu netiešās imunofluorescences reakcijā; 2) Islettest "Islettest" firma "Biomerica". Autoantibody insulīna (IAA) tika noteikta enzīmu testā "Islettest" Biomerica. Antivošanos definīcija DGC tika veikta, izmantojot uzņēmuma "Boehringer Mannheim" standarta komplektus.
C-peptīda definīcija tika veikta, izmantojot uzņēmuma "Sorrin" standarta komplektus (Francija).
HLA rakstīšana pacientiem ar SD un viņu ģimenēm tika veikta trīs gēni: DRB1, DQA1 un DQB1 ar Sicken-Spec - "" Cyphic Primers, izmantojot polimerāzes ķēdes reakciju (PCR).
DNS atbrīvošana no perifērās asins limfocītiem tika veikta saskaņā ar R. Higuchi N. Erlich (1989) metodi ar dažiem izmaiņām: 0,5 ml asinīs ar EDTA, sajaukts 1,5 ml mikrocentrifūgas caurulēs, piemēram, EPPendorf ar 0,5 ml lizuing šķīdums, kas sastāv no 0,32 m saharozes, 10 mm Tris - NS1 pH 7,5, 5mm mgc12, 1% tritone X-100, centrifugēts 1 min 10 000 apgr./min, supernatants tika noņemts, un šūnu serdeņu 2 reizes mazgāti ar Norādītais buferis. Turpmāko proteolīzi tika veikta 50 μl bufera šķīduma, kas satur 50 mm KCI, 10 mm TRIS-NS1 pH 8.3, 2,5 mm MGCI2, 0,45% NP-40, 0,45% TWIN-20 un 250 μg / ml proteināzes k 37 "C 20 minūtes. Inaktivēta proteinase līdz apkurei cietā stāvoklī termostats 95 collu 5 minūtes. Iegūtie DNS paraugi tika nekavējoties izmantoti, lai ievadītu vai uzglabātu -20 "s. DNS koncentrācija, ko nosaka
fluorescence ar Hoechst 33258 uz DNS fluorimetra (Hoefer, ASV), vidēji 50-100 μg / ml. Kopējais DNS izolācijas procedūras laiks bija 30-40 minūtes.
PCR tika veikta 10 μl reakcijas maisījuma, kas satur 1 μl DNS parauga un šādas atlikušo sastāvdaļu koncentrācijas: 0,2 mm katra DNTF (DNTF (DATF, DTTF, DTTF un DGTF), 67mm TRIS-HCL PH \u003d 8.8, 2.5. mm MGC12, 50 mm NaCl, 0,1 mg / ml želatīna, 1 mm 2-merkaptoethanol, kā arī 1 vienības termostablējamā DNS polimerāze. Lai novērstu izmaiņas reakcijas maisījuma sastāvdaļu koncentrācijā kondensāta veidošanās dēļ, reakcijas maisījums tika pārklāts ar 20 μl minerāleļļas (Sigma, ASV).
Pastiprināšana tika veikta MS2 daudzkanālu Thermal Cycler (AS, Maskava DNS tehnoloģija.
Rakstīt DRB1 lokus tika veikta 2 posmos. 1. kārtā, genoma DNS tika pastiprināts divās dažādās caurulēs; Pirmajā testa caurulē, pāris primers pastiprina visas zināmās alēles no DrB1 gēnu, 2. - pāris grunts, pastiprinot tikai alēles, kas iekļautas DR3, DR5, DR6, DR8 grupās tiek izmantotas. Abos gadījumos amplifikācijas temperatūra (termociklam "MS2" ar aktīvo regulu) bija šāds: 1) 94 ° C - 1 min; 2) 94 ° C - 20 C (7 cikli), 67 "C - 2 C; 92 "C - 1 C (28 cikli); 65 ° C - 2 s.
Iegūtie produkti bija šķīries 10 reizes un izmantoti 2. kārtā nākamajā temperatūras režīmā: 92 "C - 1 C (15 cikli); 64 ° C - 1 S.
Rakstīšana DQA1 Locus tika veikta 2 posmos. 1. posmā tika izmantots pāris grunts, pastiprinot visu DQA1 lokusa specifiku, otrajā - pāros gruntēšanas, amplitūdas ficizējošā specifika * 0101, * 0102, * 0103, * 0201, * 0301, * 0401, * 0501, * 0601.
Pirmais posms tika veikts saskaņā ar programmu: 94 "C - 1 min; 94 ° C - 20 C (7 cikli), 58 "C - 5 C; 92" C - 1 C, 5 C (28 cikli), 56 "C - 2 s.
1. posma amplifikācijas produkti bija šķīrušies 10 reizes un izmantoti 2. posmā: 93 "C - 1 C (12 cikli), 62" C - 2 s.
Tipēšana DQB1 Locus tika veikta arī 2 posmos; Pāris primāriem pastiprinot visu DQB1 lokusa specifiku, temperatūras režīms ir šāds: 94 "C - 1 min.; 94 ° C - 20 s. (7 cikli); 67" C - 5 S.; 93 ° C - 1 C (28 cikli); 65Ls - 2 p.
2. posms, ko izmanto grunts pāri, pastiprinot specifiku: * 0201, * 0301, * 0302, * 0303, * 0304, * 0305, * 04, * 0501, * 0502, * 0503, * 0601, * 0602/08; 1. posma produkti bija šķīries 10 reizes un pastiprināti režīmā: 93 "C - 1 s. (12 cikli); 67" C - 2 s.
Pastiprināšanas produktu identificēšana un to garuma izplatīšana tika veikta ultravioletajā gaismā (310 nm) pēc elektroforēzes 15 minūtes vai 10% paag, 29: 1 pie 500V sprieguma vai 3% agarozes želeja pie sprieguma 300 V (in Abi gadījumi, nobraukums bija 3-4 cm) un krāsošana ar bromīdu etidiju. Kā garums garums, PUC19 plazmid Puc19 ierobežota MSP es biju izmantots.
Rezultāti un tā diskusija
Ir konstatēts, ka 26 ģimenēs no 26 pacientiem SD 1 vecāki vecāki veidi 23 cilvēki (88,5%) ir pārvadātāji, kas saistīti ar DRB1 * 05-DQA1 * 0501 - DQB1 * 0201, kas saistīts ar DQB1 * 0201 - DQB1 * 0201; DRB1 * 04-DQAL * 0301-DQB 1 * 0302 vai to kombinācijas (2. tabula). 2 pacientiem genotipā ir alēle DQB 1 * 0201, kas saistīts ar tipa tipu; Tikai 1 pacients no šīs grupas atklāja DrB1 * 01/01 Genotipu, kas
Genotipu izplatīšana pacientiem ar SD 1 vecāku veidu
01? 1 4/4 2 e1? 1 - - -
Kopā 23 (88,5%) kopā 3
0і? B1-Roa-Ro Gaplotipi, ko noteicis aptaujātās personas
oOGVі OOі R)
rY ar iedzīvotāju pētījumiem nebija saistīta ar 1. tipa tipu, mēs nepiešķirām B1 * 04 apakštipus, lai gan šīs lokusa polimorfisms var ietekmēt 1. tipa SD risku.
Genotipā tiešu pēcteču pacientiem ar 1. tipu, tika atklāts, ka no 37 cilvēkiem 30 (81%), kas mantoti, kas saistīti ar SD 1 no Genotipu ov1 * 03, 011v1 * 04 veida un to kombinācijas, 3 personām Genotips ir saistīts ar SD 1 no All All 1: 1 - OOA 1 * 0501, 2 pacientiem -oov 1 * 0201. Kopumā 4 no 37 aptaujātajiem ir neitrāls genotips attiecībā uz 1. tipa tipu.
Pēcnācēju genotipu sadalījums ir norādīts tabulā. 3. vairākos "darbos, jāatzīmē, ka SD 1 tipa tēvu pacienti biežāk pārraida ģenētisko predispozi
nepatiesa diabētam (jo īpaši Na-01 * 4-ģenētiskie veidi) saviem bērniem nekā māte. Tomēr pētījums Apvienotajā Karalistē neapstiprināja vecāku dzimuma būtisko ietekmi uz kodola nosliece bērniem. Mūsu darbā mēs arī nevaram atzīmēt šādu ģenētiskās noslieces nodošanas regularitāti: no pacientiem ar mātēm, kas saistītas ar SD 1 tipu NY genotipiem, kas mantojuši 94% bērnu un no pacientiem ar tēviem - 85%.
SD, kā zināms, ir multigēnu daudzfaktoru slimība. Kā ārējās vides faktori, kas spēlē sprūda lomu, pārtika tiek uzskatīta par govs piena olbaltumvielu krūts patēriņu un agrīnu bērnību. De
3. tabula.
Genotipu izplatīšana bērniem, kuru vecāki ir slimi 1 tips
Gotipi, kas saistīti ar SD 1 tipa multivides pārvadātāju skaits, kas nav saistīts ar SD 1 tipa mediju skaitu
0! * 1 4/4 4 01 * pie 1 1/15 1
Kopā 30 (81%) tikai 7 (19%)
ar nesen atklāto diabētu, ir paaugstināts antivielu līmenis attiecībā uz olbaltumvielu govs piena piena, P-lactoglobulīna un bullshit albumīna, salīdzinot ar veseliem SIB, kas tiek uzskatīti par neatkarīgu riska faktoru SD.
Pārbaudīto bērnu grupā no 37 cilvēkiem tikai 4 bija zīdīšanas līdz 1 gadam, 26 cilvēki saņēma mātes pienu līdz 1,5-3 mēnešiem, 4 - 6 mēnešiem, 3 bija piena maisījumos no pirmās dzīves nedēļas. 5 bērni ar pozitīvām antivielām līdz P-šūnām 2 baroja bērnu ar krūti līdz 6 mēnešiem, 3 - līdz 1,5 - 3 mēnešiem; Tad tika iegūti kefīra un piena maisījumi. Tādējādi 89% aptaujāto bērnu saņēma govs piena olbaltumvielas sirds vecumā un agrā bērnībā, ko var uzskatīt par SD attīstības riska faktoru ģenētiski predistiskajās personām.
Pārbaudītajās ģimenēs klīniski veselīgi pēcnācēji tika noteikti citoplazmas antivielas, autoantibodes uz insulīnu un DGC. No 37 aptaujātajiem 5 bērniem bija pozitīvi pret antivielu klātbūtni uz P-šūnām, bet visi 5 ir ģenētiskās jutības pārvadātāji pret SD (4. tabula). 3 no tiem (8%) tika atrasti antivielas uz DGC, 1 - uz AZok, 1 - antivielas uz AZOK
4. tabula.
Gotipi bērniem pozitīvi pret antivielām K (3 šūnas
Gotipa skaits pozitīvo antivielu
un insulīns. Tādējādi antivielas uz Azok ir 5,4% bērnu, 2 bērni ar pozitīvām antivielām DGC ir pēctečiem "kodolieroču" ģimenēm. Bērnu vecums antivielu atklāšanas laikā ir norādīts tabulā. 5. Lai prognozētu SD, Azok titra līmenis ir ļoti svarīgs: jo augstāks antivielu nosaukums, jo lielāka ir SD attīstības iespējamība, tas pats attiecas uz antivielām pret insulīnu. Saskaņā ar literatūru augsts antivielu līmenis DGC ir saistītas ar Lēnāku SD attīstības tempu (10% 4 gadu laikā) nekā zems līmenis (50% 4 gadi), varbūt tāpēc, ka antivielu līmeņi uz DGC norāda "vēlamo" aktivizēšanu humorālās imunitātes un mazākā mērā, lai aktivizētu šūnu
5. tabula.
Aptaujāto bērnu vecums antivielu atklāšanas laikā
Aptaujāto bērnu vecums (gadi) Bērnu skaits ir pozitīvs pret antivielām
imunitāte (1. tipa SD 1 veids galvenokārt ir saistīts ar šūnu netiešu iznīcināšanu ar citotoksiskiem t-limfocītiem). Dažādu antivielu kombinācija nodrošina optimālo prognozēšanas līmeni.
Bērniem ar zemu ķermeņa masu dzimšanas brīdī (mazāk nekā 2,5 kg) diabēts attīstās ievērojami agrāk nekā bērniem, kas dzimuši ar normālu masu. No anamnīzes datiem fakts, ka no 5 bērniem ar pozitīvām antivielām 2 dzimis ar ķermeņa masu vairāk nekā 4 kg, 2,9 kg 2,9 kg.
Tiešos pacientu pēcnācējus ar pacientu tipa tipa tips ir noteikts, ka C-peptīda bazālais līmenis ir noteikts, viss šis rādītājs bija normālā diapazonā (tostarp bērniem ar pozitīvām antivielām uz R-šūnām), līmeņa pētījums stimulēta C-peptīda netika veikta.
1. 1. tipa tipa pacienti 88,5% gadījumu ir atvasināto finanšu instrumentu genotipu, OOA1 * 0501, VOV1 * 0201, OV1 * 04, BOA1 * 0301, EOB1 * 0302 vai to kombinācijas.
2. Bērniem no ģimenēm, kur viens no vecākiem slimo 1 tipa paraugu, 89% gadījumu, ģenētiska nosliece uz SD (viena pacienta mātes klātbūtnē), un 81% mantot pilnībā saistīti ar SD 1 veidu Genotipi, kas ļauj viņiem uzskatīt tos par ļoti lielu diabēta riska grupu.
3. Starp tiešajiem pēcnācējiem pacientiem ar SD 1 tipu, kam ģenētiska nosliece, pozitīvās antivielas DGC atklājas 8% gadījumu, ACOC - 5,4% gadījumu. Šiem bērniem ir nepieciešams diagnostikas pētījums par antivielu titriem, glikēmoglobīnu un insulīna sekrēcijas izpēti.
* 1 iterāts
1. Atkinson M.A., McLaren N.K. // N.ENGL.J.MED.-L 994 -331. P.L 4281436.
2. AANSTOOT H.J., Sigurdson E., Jaffe M. et al // diabetologia-1994-37.
3. Baekkeskov S., Aanstoot H.J., Christang S. et al // Daba-1 990-377.
4. Bain S.C., Rowe B.R., Barnett A.H., Toddj.a. // diabēts-1994-43 (12). P. 1432-1468.
5. B / NG / EY P.J., Christie M.R., Bonifacio E., Bonfanti R., Shattock MW Fonte M.T., Bottazzo C.F. // diabēts-1 994-43. P. 1304-1310.
6. Boehn B.O., Moncra B., Seiblerj. et al // diabēts-1991-40. P.1435-1439.
7. Chern M.M., Anderson V.E., Barbosa J. // diabēts-1982-31. P.L 1 151118.
8. Davies J.L., Kawaguchi Y., Bennett S.T. un citi. // Daba-1994-371.
9. Erlich H.a., Rotter J.I., Chang J. et al. // Daba Gen.-1993-3. P.358-364.
10. Hahl J., Simell T., Ilonen J., Knip M., Simmel O. // Diabetologia-1 99841. lpp. 79-85.
11. Harrison L.c., Honeyman M.c., Deiepurua H.J. et al // Lancet-1993341. P.365-1369.
12. Hashimoto L., Fabreja C., Beresse J.P. un citi. // Daba-1994-371. P.161-164.
1 3. Karjalainen J., Martin J.M., knip M. et al // n.engl.j.med.-l 992-327. P.302-303.
14. Khan N., Coupert.t., // diabēta aprūpe-1994-17. P. 653-656.
15. Landin-Oisson M., Palmer J.P., LernMark A. et al // diabetologia-1992-40. P.L068-1 073.
16. Leslie R.D.C., Atkinson M.a., Notkins a.l. // diabetoloģija-1999-42. P.3-14.
17. Levy-Marchal C., Dubois F., Neel M., Tichetj., Czernichow P. // diabēts-1995-44. P.1029-1032.
1 8. Lorenzen T., Pociar F., Hoafaard P., Nerup J. // Diabetologia-1994-37. P.321-321.
19. Lorenzen T "Pociot F., Stilgren L. et al // diabetologia-1998-41. P.666-673.
20. NEPOM G., Erlich H.a. // ann.rev.immunol.-1 991-9. P.493-525.
21. Nerup J., Manrup-Poulsen T., Molvig J. // diabēta metab. Rev.-1987-3. P.779-802.
22. owerbach D., gabbay k.h. // diabēts-1995-44.p.l 32-136.
23. Pociotf. U dan.med.bull.-L996-43. P.216-248.
24. Rewers M., Bugawan T.L, Norris J.M., Blair A. et al. // diabetoloģija-1996-39. P.807-812.
25. Rei / Onen H., Ilonen J., Knip N., AKERBLOM H. // Diabēts-1 991-40.
26. SAUKKONEN T., Virtanen S.M., Karppinen M. et al // diabetologia-1998-41. P.72-78.
27. Schatz D., Krischerj., Horne G. et al // J. Clin. Invest.-1994-93. P.2403-2407.
28. Spielman R.s., Baker L, Zmijewski C.M. // ann. Hum. Genet.-1980-44. P. 135-150.
29. Thivolet C., Beaufrere B., Gebuhrer Y., Catelain P., Orgiazi J. // Diabetologia-1991 -34. P.L86-191.
30. Tills H., Kobberling J.// Diabēts-1982-36. P.93-99.
31. Toddj.a. U proc. NATL. Acad. SCI. ASV-1990-377. P.8560-8565.
32. Toddj.a, Farral M. // hum.mol.gen.-5. P.1443-1448.
33. Tuomilehto J., Zimmet P., Mackay I.R. et al // Lancet-1994-343.
34. Van der Anvera B., Van Waeyenegenge C., Schuit F. et al. // diabēts-1995-44. P.527-530.
35. WALKER A. GUDWORT AG. // diabēts-1980-29. P.1036-1039.
36. Warram J., Krolewski A.S., Gottlieb M., Kahn C.R. // n.engl.j.med.-1984-311. P.149-151.
37. Zieger A.g., Herskowitz R.., Jackson R.a. et al // diabēta aprūpe-1990-13. P.762-775.




