Mēs iesniedzam jūsu uzmanību video apmācība, kas veltīta benzola ķīmiskajām īpašībām. Izmantojot šo video materiālu, jūs varat iegūt priekšstatu par benzola ķīmiskajām īpašībām, kā arī stingriem apstākļiem, kas nepieciešami, lai benzols reaģētu ar citām vielām.
Temats:Aromātiskie ogļūdeņraži
Nodarbība:Benzola ķīmiskās īpašības.
Fig. 1. Benzola molekula
Benzola molekulā ir sarežģīta p-elektroniskā mākonis. Tāpēc benzols iekļūst ķīmiskās reakcijas daudz mazāk aktīvi, salīdzinot ar nepiesātinātajiem savienojumiem.


Lai benzols nonāktu ķīmiskās reakcijas, ir nepieciešami diezgan stingri apstākļi: palielināta temperatūra, un daudzos gadījumos - katalizators. Lielākajā daļā reakciju tiek saglabāts stabils benzola gredzens.
1. Bromēšana.

Ir nepieciešams katalizators (dzelzs (III) vai alumīnija bromīds), un tas ir nepieņemami ieiet pat nelielu daudzumu ūdens. Katalizatora loma ir tā, ka broma molekulu piesaista viens no dzelzs atoma broma atomiem. Tā rezultātā tā polarizē - telekomunikāciju pāris mainās uz broma atomu, kas saistīts ar dzelzi:
Br + ... BR - FR 3.
BR + - spēcīgs elektrofils. To piesaista sešu elektronu mākoni benzola gredzenu un saplīst to, veidojot kovalentu saikni ar oglekļa atomu:
Anjonu broms varētu pievienoties veidotajam katjonam. Taču benzola gredzena aromātiskās sistēmas atjaunošana ir enerģiski izdevīgāka nekā broma anjona pievienošana. Tāpēc molekula nonāk stabilā stāvoklī, throwing ūdeņradis jonu:
Ar līdzīgu mehānismu, visas elektrofilās nomaiņas reakcijas benzola gredzenā plūst.
2. Nitrēšana

Benzols un tās homologi mijiedarbojas ar koncentrētu sērskābes un slāpekļskābju maisījumu (nitrifizējošs maisījums). Vītnes maisījumā līdzsvarā ir nitronium jonu Nr. 2 +, kas ir elektrofils:

3. Sulfonācija.
Benzols un citas arēnas, ja apsildāmās reaģē ar koncentrētu sērskābi vai oleum - tik 3 šķīdums sērskābē:

4 . Alkilācija saskaņā ar Friedel Korfest
5. Alkilācija Alkenes

Šīs reakcijas ir enerģiski nelabvēlīgas, tāpēc turpinās tikai tad, ja apsildīts vai apstarojis.
1. hidrogenēšana.
Sildot, paaugstināts spiediens un ni, PT vai PD katalizatora klātbūtnē, benzols un citas arēnās pievienoties ūdeņradi, veidojot cikloheksānu:

2. Benzola hlorēšana.
Saskaņā ar ultravioletā starojuma iedarbību Benzols pievienojas hloram. Ja kolba no kvarca stikla ar hlora šķīdumu benzēnā, lai segtu saules gaismā, risinājums ātri izplūst, hlors savienosies ar benzolu, lai veidotu 1,2,3,4,5,6-hekslorcikloheksānu, kas ir pazīstams kā nosaukums sauc hexakhloran (Iepriekš piemērots kā insekticīds):

3. Benzola dedzināšana.
Atšķirībā no alkāniem, liesma benzola un citos aromātiskajos ogļūdeņražos ir gaiša, smēķēšana.
Apkopojot nodarbību
Šajā stundā jūs pētījāt tēmu "Benzola ķīmiskās īpašības". Izmantojot šo materiālu, jūs varētu iegūt priekšstatu par benzola ķīmiskajām īpašībām, kā arī stingriem apstākļiem, kas nepieciešami, lai benzols reaģētu ar citām vielām.
Bibliogrāfija
1. Rudzīts G.E. Ķīmija. Vispārējās ķīmijas pamati. 10. klase: apmācība vispārējās izglītības iestādēm: pamata līmenis / G. E. Rudzīts, f.g. Feldman. - 14. izdevums. - m.: Apgaismība, 2012.
2. Ķīmija. 10. pakāpe. Profila līmenis: studijas. Vispārējai izglītībai. Iestādes / V.V. Eremin, n.e. Kuzmenko, V.V. Lunin et al. - M.: Drop, 2008. - 463 p.
3. Ķīmija. 11. klase. Profila līmenis: studijas. Vispārējai izglītībai. Iestādes / V.V. Eremin, n.e. Kuzmenko, V.V. Lunin uc. - M.: Drop, 2010. - 462 p.
4. Homchenko G.P., Khomchenko I.g. Ķīmijas uzdevumu iekļūšana universitātēs. - 4. ed. - M.: RIA "New Wave": Publiseru izdevējs, 2012. - 278 p.
Mājasdarbs
1. Nr. 13, 14 (62. lpp.) Rudzīts G.E., Feldman F.G. Ķīmija: Organiskā ķīmija. 10. klase: apmācība vispārējās izglītības iestādēm: pamata līmenis / G. E. Rudzīts, f.g. Feldman. - 14. izdevums. - m.: Apgaismība, 2012.
2. Kāpēc aromātiskie savienojumi ķīmiskajās īpašībās atšķiras gan no limita, gan nelīdzenām ogļūdeņražiem?
3. Uzrakstiet etilbenzola un ksiloles sadegšanas reakciju vienādojumus.
Pirmā reakciju grupa - aizvietošanas reakcijas. Mēs teicām, ka arēnām nav vairāku obligāciju molekulas struktūrā, bet satur sešu elektronu konjugātu sistēmu, kas ir ļoti stabila un dod papildu spēku benzola gredzenam. Tāpēc ķīmiskajās reakcijās ūdeņraža atomu aizstāšana galvenokārt notiek, nevis benzola gredzena iznīcināšana.
Ar reakciju aizvietošanas, mēs jau saskārāmies, runājot par Alkans, bet viņiem šīs reakcijas tika gājusi pa radikālu mehānismu, un jonu mehānisms reakciju aizstāšanas raksturo arēnā.
PirmkārtĶīmiskais īpašums - halogenēšana. Ūdeņraža atoma nomaiņa uz halogēna atoma - hlora vai broma.
Reakcija tiek uzsildīta un obligāti piedaloties katalizatora. Attiecībā uz hloru, tas var būt alumīnija hlorīds vai dzelzs hlorīds trīs. Katalizators polarizē halogēna molekulu, kā rezultātā notiek heterolitiskā komunikācijas pārtraukums un tiek iegūti joni.
Pozitīvi uzlādēts hlora jonu un reaģē ar benzolu.
Ja reakcija notiek ar bromu, tad katalizators ir dzelzs bromīds trīs vai alumīnija bromīds.

Ir svarīgi atzīmēt, ka reakcija notiek ar molekulāro bromu, nevis ar broma ūdeni. Ar broma ūdeni, benzols nereaģē.
Gologistu benzola halogenēšana ir savas īpašības. Toluolā molekulā, metilgrupa atvieglo aizvietošanu gredzenā, reaģētspēja palielinās, un reakcija iet zem viegliem apstākļiem, tas ir, istabas temperatūrā.

Ir svarīgi atzīmēt, ka aizvietošana vienmēr notiek orto- un pāra pozīcijās, tāpēc iegūst izomēru maisījumu.
OtrkārtĪpašuma - benzola nitrēšana, nitro grupas ieviešana benzola gredzenā.

Tiek veidots smags dzeltenīgs šķidrums ar rūgta mandeļu smaržu - Nitrobenzene, tāpēc reakcija var būt augstas kvalitātes benzola. Vītņošanai tiek izmantota koncentrētu slāpekļa un sērskābju nitrāta maisījums. Reakcija tiek veikta, apsildot.
Ļaujiet man atgādināt, ka par alkanānu nitrēšanu Konovalova reakcijā tika izmantota atšķaidīta slāpekļskābe, nepievienojot sēru.
Toluola vītņošanā, kā arī halogenēšanas laikā veidojas orto- un parametriju maisījums.

TrešaisĪpašums - alkilācija Benzola Halolens.

Šī reakcija ļauj ieviest ogļūdeņražu radikālu benzola gredzenā, un to var uzskatīt par metodi benzola homologu ražošanai. Alumīnija hlorīdu izmanto kā katalizatoru, kas veicina halogēna molekulas samazinājumu joniem. Nepieciešama arī apkure.
CeturtaisĪpašums - alkilācija Benzola alkenes.

Šādā veidā ir iespējams iegūt, piemēram, ķimulāru vai etilbenzolu. Katalizators - alumīnija hlorīds.
2. Pielikuma reakcijas uz benzolu
Otrā reakciju grupa - pielikuma reakcija. Mēs teicām, ka šīs reakcijas nav raksturīgas, bet tās ir iespējamas pietiekamas cietos apstākļos, iznīcinot PI-elektronisko mākoņu un sešu sigma obligāciju veidošanos.
PiektaisĪpašums kopējā sarakstā ir hidrogenēšana, ūdeņraža pievienošana.
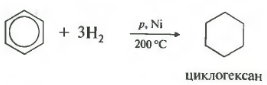
Temperatūra, spiediens, niķelis vai platīna katalizators. Tādā pašā veidā toluols spēj reaģēt.
SestaisĪpašums - hlorēšana. Lūdzu, ņemiet vērā, ka mēs runājam par mijiedarbību ar hloru, jo broms neietver šo reakciju.
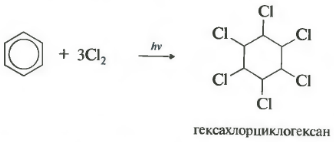
Reakcija notiek ar stingru ultravioleto apstarošanu. Heksahlorcikloheksāns veidojas, vēl viens heksahlororāna nosaukums, ciets.
Ir svarīgi atcerēties, ka benzols nav iespējams Halogēna ūdeņraža ūdeņraža (hidroaturācijas) un ūdens savienojuma (hidratācijas) reakcijas.
3. Nomaiņa sānu ķēdē Benzola homologi
Trešā reakciju grupa attiecas tikai uz Benzola homologiem - tas ir aizvietojums sānu ķēdē.
Septītā daļaĪpašums kopējā sarakstā ir halogenēšana pa alfa oglekļa sānu ķēdē.

Reakcija notiek sakarā vai apstarotā un vienmēr ir tikai alfa oglekļa. Ar turpināšanu halogenizāciju, otrais halogēna atoms atkal pieaugs alfa pozīcijā.
4. Benzola homologu oksidācija
Ceturtā reakciju grupa - oksidācija.
Benzola gredzens ir pārāk izturīgs, tāpēc benzols nelietojiet oksidēt Permangana kālija - neizplata savu risinājumu. Ir ļoti svarīgi atcerēties.
Bet benzola golologi tiek oksidēti ar paskābinātu kālija permanganāta šķīdumu sakarā. Un tas ir astotais ķīmiskais īpašums.

Izrādās benzoskābe. Ir šķīduma krāsas izmaiņas. Tajā pašā laikā neatkarīgi no tā, cik ilgi aizvietotāja oglekļa ķēde vienmēr notiek pēc pirmās oglekļa atoma un alfa-atomu oksidēts uz karboksilgrupu ar benzoskābes veidošanos. Atlikušo molekulas daļu oksidē uz atbilstošu skābi vai, ja tas ir tikai viens oglekļa atoms, uz oglekļa dioksīdu.
Ja benzola gomologam ir vairāk nekā viens ogļūdeņražu aizvietotājs aromātiskā gredzenā, tad oksidācija notiek saskaņā ar tiem pašiem noteikumiem - oglekļa oksidējas alfa pozīcijā.

Šajā piemērā iegūst divu saistošu aromātisko skābi, ko sauc par ftalīnskābi.
Īpašā veidā es atzīmēšu ķimola, izopropilbenzola oksidāciju sērskābes klātbūtnē.

Tā ir tā sauktā fenola iegūšanas metode. Parasti ir nepieciešams saskarties ar šo reakciju jautājumos, kas saistīti ar fenola saņemšanu. Tas ir rūpniecisks veids.
DevītaisĪpašums - dedzināšana, pilnīga oksidēšanās skābeklis. Benzols un tās homologi sadedzina oglekļa dioksīdu un ūdeni.
Mēs uzrakstām vienādojumu sadegšanas benzola kopumā.
Saskaņā ar likumu par atomu masu saglabāšanu, pa kreisi vajadzētu būt tikpat daudz kā atomi pa labi. Jo, galu galā, ķīmiskās reakcijas, atomi nav iet nekur, bet vienkārši maina savienojumu secību starp tiem. Tātad, oglekļa dioksīda molekulas būs tikpat daudz kā oglekļa atomi transportlīdzekļa molekulā, jo viens oglekļa atoms ietver molekulas sastāvu. Tas ir, n molekulas CO 2. Ūdens molekulas būs divas reizes mazāk nekā ūdeņraža atomi, kas ir, (2N-6) / 2, kas nozīmē n-3.
Skābekļa atomi pa kreisi un pa labi no tāda paša summa. Pa labi no tiem 2n no oglekļa dioksīda, jo katrā molekulā, divi skābekļa atomi, kā arī N-3 ūdens, un 3N-3. No skābekļa atomu kreisais ir tāds pats - 3N-3, kas nozīmē molekulas divas reizes mazāk, jo molekulas sastāvs ietver divus atomus. Tas ir, (3N-3) / 2 skābekļa molekulas.
Tādējādi mēs izveidojām Benzola homologue sadegšanas vienādojumu kopumā.
Definīcija
Benzols (cikloheksitrien - 1,3,5) - organiskā viela, vienkāršākais pārstāvis vairāku aromātisko ogļūdeņražu.
Formula - C 6 H 6 (strukturālā formula - 1. att.). Molekulmasa - 78, 11.
Fig. 1. Benzola konstrukcijas un telpiskās formulas.
Visi seši oglekļa atomi benzola molekulā ir SP 2 hibrīda stāvoklī. Katrs oglekļa atoms veido 3σ-obligācijas ar diviem citiem oglekļa atomiem un vienu ūdeņraža atomu, kas atrodas vienā plaknē. Seši oglekļa atomi veido pareizo sešstūra (σ-skelets no benzola molekulas). Katram oglekļa atomam ir viens nav minēts P-orbitāls, kurā atrodas viens elektrons. Seši P-elektroni veido vienu π-elektronu mākonis (aromātisko sistēmu), kas ir attēlota ar apli sešu locekļu ciklu. Ogļūdeņražu radikāli iegūti no benzola sauc par C 6 H 5 - - fenil (ph-).
Benzola ķīmiskās īpašības.
Attiecībā uz benzolu, reakcijas aizvietošana plūst caur elektrotilora mehānismu ir raksturīgi:
- halogenēšana (benzols mijiedarbojas ar hloru un bromu katalizatoru klātbūtnē - bezūdens alcl 3, FECL 3, Albr 3)
C 6 h 6 + cl 2 \u003d c 6 h 5 -cl + hcl;
- Nitrēšana (Benzols viegli reaģē ar nitrifīdu maisījumu - koncentrētu slikto un sērskābju maisījumu)

- alkilācija alkēnu
C 6 H 6 + CH 2 \u003d CH-CH 3 → C 6 H 5 -CH (CH 3) 2;
Pielikuma reakcija uz benzolu noved pie aromātiskās sistēmas iznīcināšanas un turpinās tikai skarbos apstākļos: \\ t
- hidrogenēšana (reakcija notiek sakarā, katalizators - PT)

- hlora pievienošana (ieņēmumi pēc UV starojuma iedarbības veidot stabilu produktu - heksahlorcikloheksānu (hexahlor) - C 6 h 6 cl 6)

Kā arī jebkurš organiskais savienojums, benzols ievada sadegšanas reakciju uz oglekļa dioksīda un ūdens veidošanos kā produktus (dedzināšana ar dzesētāju liesmu):
2C 6 H 6 + 15O 2 → 12CO 2 + 6H 2 O.
Benzola fizikālās īpašības.
Benzols ir šķidrums bez krāsas, bet kam ir konkrēta asa smarža. Veido azotropu maisījumu ar ūdeni, tas ir labi sajaukts ar ēteriem, benzīnu un dažādiem organiskiem šķīdinātājiem. Viršanas punkts - 80.1C, kausēšana - 5,5. Toksisks, kancerogēns (I.E. veicina onkoloģisko slimību attīstību).
Benzola iegūšana un izmantošana
Benzenes ražošanas galvenās metodes:
- heksāna dehidrociklicācija (katalizatori - pt, cr 3 o 2)
CH3 - (CH2) 4 -CH3 → C 6 H 6 + 4H 2;
- cikloheksāna dehidrogenēšana (reakcija notiek, ja apsildīts, katalizators - PT)
C 6 H 12 → C 6 H 6 + 4H 2;
- acetilēna trikerizācija (reakcija notiek, sakārtoti līdz 600C, katalizators - aktivizēts ogleklis)
3HC≡CH → C 6 H 6.
Benzols kalpo kā izejvielas homologu ražošanai (etilbenzols, kumla), cikloheksāns, nitrobenzene, hlorbenzols, uc vielas. Agrāk, benzols tika izmantots kā piedevu benzīnam, lai palielinātu savu oktāna numuru, tomēr, tagad, saistībā ar tās augsto toksicitāti, benzola saturs degvielā ir stingri normalizēta. Dažreiz benzols tiek izmantots kā šķīdinātājs.
Problēmu risināšanas piemēri
1. piemērs.
| Uzdevums | Ierakstiet vienādojumus, ar kurām var veikt šādas transformācijas: CH 4 → C 2 H 2 → C 6 H 6 → C 6 H 5 CL. |
| Lēmums | Lai iegūtu acetilēnu no metāna, tiek izmantota šāda reakcija: 2CH 4 → C 2 H 2 + 3H 2 (T \u003d 1400C). Benzola sagatavošana no acetilēna ir iespējama ar acetilēna trimerizācijas reakciju, kad silda (T \u003d 600C) un aktīvās ogles klātbūtnē: 3C 2 H 2 → C 6 H 6. Hlora hlora hlora hlorbenzola reakcija tiek veikta dzelzs hlorīda (III) klātbūtnē: \\ t C 6 H 6 + CL 2 → C 6 H 5 CL + HCL. |
2. piemērs.
| Uzdevums | Līdz 39 g benzola klātbūtnē dzelzs hlorīda (III) pievienoja 1 mol no broma ūdens. Kādu vielas daudzumu un cik gramus par to, ko produkti notika? |
| Lēmums | Mēs uzrakstām vienādojumu benzola brominēšanas reakcijas klātbūtnē dzelzs hlorīda (III): C 6 H 6 + BR 2 → C 6 H 5 BR + HBR. Reakcijas produkti ir bromobenzene un bromoma. Benzola molārā masa, kas aprēķināta, izmantojot ķīmisko elementu galdu D.I. Mendeleeva - 78 g / mol. Atrodiet benzola satura daudzumu: n (C 6 h 6) \u003d m (c 6 h 6) / m (c 6 h 6); n (c 6 h 6) \u003d 39/78 \u003d 0,5 mol. Problēmas stāvoklī Benzols ievadīja reakciju ar 1 MOL bromu. Līdz ar to benzols ir īsumā un tiks veikta uz benzola papildu aprēķiniem. Saskaņā ar n reakcijas vienādojumu N (C 6 H 6): N (C 6 H 5 BR): N (HBR) \u003d 1: 1: 1, tāpēc, n (C 6 H 6) \u003d N (C 6 H 5 BR ) \u003d: N (HBR) \u003d 0,5 mol. Tad bromobenzēna un bromomotorodora masas būs vienādas: m (C 6 H 5 BR) \u003d N (C 6 H 5 BR) × m (C 6 H 5 BR); m (HBR) \u003d N (HBR) × m (HBR). Bromobenzola un bromomotodoroda molārā masas, ko aprēķina, izmantojot ķīmisko elementu galdu D.I. Mendeleeva - 157 un 81 g / mol, attiecīgi. m (c 6 h 5 br) \u003d 0,5 × 157 \u003d 78,5 g; m (HBR) \u003d 0,5 × 81 \u003d 40,5 g |
| Atbildēt | Reakcijas produkti ir bromobenzene un bromoma. Bromobenzēna un bromomotorodoroda masa - 78,5 un 40,5 g, attiecīgi. |
Arēna - aromātiskie ogļūdeņraži, kas satur vienu vai vairākus benzola gredzenus. Benzola gredzens ir 6 oglekļa atomi, starp kuriem divkāršais un viens savienojums aizstājējs.
Ir svarīgi pamanīt, ka dubultās saites benzola molekulā nav fiksētas, bet pastāvīgi pārvietojas apli.
Teritoriju sauc arī aromātiskie ogļūdeņraži. Pirmais loceklis homologās sērijas ir benzols - c 6 h 6. Kopējā formula savās homologās sērijas ir c n h 2n-6.
Ilgu laiku Benzola strukturālā formula palika noslēpums. Iegūtā formula ar divām trīskāršām saitēm nevarēja izskaidrot, ko benzols neietver savienojuma reakciju. Kā jau minēts iepriekš, saskaņā ar mūsdienu idejām, dubultās saites molekulā tiek pastāvīgi pārvietotas, tāpēc ir pareizāk vilkt tos gredzena veidā.
Sakarā ar dubultās saites Benzola molekulā, veidojas konjugācija. Visi oglekļa atomi ir SP 2 hibridizācijas stāvoklī. Valences leņķis - 120 °.
Nomenklatūra un izomeria Arenamenti
Arēna nosaukumi tiek veidoti, pievienojot nosaukumus aizstājējus uz galveno ķēdi - benzola gredzenu: benzols, metilbenzols (toluols), etilbenzols, propilbenzols utt. Deputāti, kā parasti, ir uzskaitīti alfabētiskā secībā. Ja benzola gredzenā ir vairāki aizvietotāji, pēc tam izvēlieties īsāko ceļu starp tiem.

Par Arena, strukturālā izomeria raksturo saistīta ar nodrošinājumu aizvietotājiem. Piemēram, divi aizvietotāji benzola gredzenā var atrasties dažādās pozīcijās.
Aizstājamo aizvietotāju stāvokļa nosaukums benzola gredzenā veidojas, pamatojoties uz to atrašanās vietu attiecībā pret otru. To apzīmē ar prefiksu orto, meta un tvaika. Zemāk jūs atradīsiet mnemoniskus padomus par veiksmīgu iegaumēšanu;)

Arēna iegūšana
Arēna tiek iegūta vairākos veidos:

Ķīmiskās īpašības Arenāmenti
Arēna - aromātiskie ogļūdeņraži, kas satur benzola gredzenu ar konjugētām dubultām saitēm. Šī funkcija padara reakciju pievienoties visgrūtāk (un tomēr iespējams!)
Atcerieties, ka pretstatā citiem neparedzētiem savienojumiem, benzols un tās homologi neizplatās broma ūdens un kālija permanganāta risinājumu.

© Bellevich Yuri Sergeevich 2018-2020
Šo rakstu rakstīja Bellevich Jurijs Sergeyevich un ir viņa intelektuālais īpašums. Kopēšana, izplatīšana (tostarp kopēšana uz citām vietām un resursiem internetā) vai jebkuru citu informācijas un objektu izmantošanu bez autortiesību īpašnieka iepriekšējas piekrišanas tiek sauktas pie atbildības. Lai iegūtu izstrādājuma materiālus un to izmantošanas atļauju, lūdzu, skatiet
Fiziskās īpašības
Benzols un tās tuvākās homologi ir bezkrāsaini šķidrumi ar īpašu smaržu. Aromātiskie ogļūdeņraži ir vieglāki par ūdeni un neizšķīst tajā, bet to viegli izšķīdina organiskajos šķīdinātājos - alkoholā, ēterī, acetonā.
Benzols un viņa homologi paši ir labi šķīdinātāji daudzām organiskām vielām. Visas arēnas dedzina smēķēšanas liesmu, jo VIK molekulu augsts oglekļa saturs.
Dažu arēnā fiziskās īpašības ir norādītas tabulā.
Tabula. Dažu arēna fizikālās īpašības
|
Nosaukt |
Formula |
t °. Drop, |
t ° .kip., |
|
Benzols |
C 6 H 6 |
5,5 |
80,1 |
|
Toluols (metilbenzols) |
C 6 h 5 сh 3 |
95,0 |
110,6 |
|
Etilbenzols |
C 6 H 5 C 2 H 5 |
95,0 |
136,2 |
|
Ksilēns (dimetilbenzols) |
C 6 H 4 (SH 3) 2 |
||
|
orto- |
25,18 |
144,41 |
|
|
meta- |
47,87 |
139,10 |
|
|
pāris |
13,26 |
138,35 |
|
|
Propillbenzene. |
No 6 n 5 (ch 2) 2 ch 3 |
99,0 |
159,20 |
|
Kumol (izopropilbenzols) |
C 6 H 5 CH (CH 3) 2 |
96,0 |
152,39 |
|
Stirola (vinilbenzols) |
C 6 h 5 ch \u003d ch 2 |
30,6 |
145,2 |
Benzols - gaismas vārīšanās ( t. kumoss\u003d 80,1 ° C), bezkrāsains šķidrums, neizšķīst ūdenī
Uzmanību! Benzols - inde, darbojas uz nierēm, maina asins formulu (ar ilgtermiņa iedarbību), var tikt pārkāpta hromosomu struktūra.
Lielākā daļa aromātisko ogļūdeņražu ir bīstami dzīvībai, toksiskiem.
Saņem arēnā (benzols un viņa homologi)
Laboratorijā
1. Benzoskābju sāļu grīdas segums ar cietiem sārmiem
C 6 h 5 -coona + naoh T →C 6 H 6 + NA 2 CO 3
nātrija benzoāts
2. Nureza montāžas reakcija: (šeit g - halogēna atoms)
Ar 6.H. 5 -G + 2.Na. + R.-G →C. 6 H. 5 - R. + 2 Na.G.
No 6 H 5 -cl + 2NA + CH 3 -CL → C 6 H 5 -CH 3 + 2NACL
Rūpniecībā
- izolēts no naftas un oglēm, izmantojot frakcionētu destilāciju, reformu;
- no sveķu un koksa gāzes
1. Alkanov Dehydrocyclication Ar oglekļa atomu skaitu vairāk nekā 6:
C 6 h 14 T. , Kat.→ C 6 H 6 + 4H 2
2. Acetilēna trimmerizācija (tikai benzēnam) - r. Zelinsky:
3c 2. H 2. 600 ° C. , Tēlot. ogles → C 6 h 6
3. Dehidrizācija Cikloheksāns un viņa homologi:
Padomju akadēmiķis Nikolai Dmitrievich Zelinsky atklāja, ka Benzols veidojas no cikloheksāna (cikloalkāna dehidrogenācija
C 6 H 12 T, kat.→ C 6 H 6 + 3H 2

C 6 h 11 -CH 3 T. , Kat.→ C 6 H 5 -CH 3 + 3H 2
metilcikloheksantoluole
4. Alkilēšana Benzola. (Iegūstot gomologu benzolu) - R Fridel Korflas.
C 6 h 6 + c 2 h 5 -cl T, alcl3→ C 6 H 5-C2 H 5 + HCL
hlorhetāns etilbenzols

Ķīmiskās īpašības Arenāmenti
I.. Oksidācijas reakcijas
1. Degšana (smēķēšanas liesma):
2C 6 H 6 + 15O 2 T. → 12CO 2 + 6H 2 O + Q
2. Benzols normālos apstākļos neizmanto broma ūdeni un mangāna šķīdumu
3. Benzola homologus oksidē kālija permanganāts (brainorēts mangāna):
A) skābā vidē uz benzoskābi
Saskaņā ar kālija permanganāta gomologiem un citiem spēcīgiem oksidētājiem, sānu ķēdes oksidējas. Neatkarīgi no tā, cik grūti ķēde aizvietojošās, tas tiek iznīcināts, izņemot -atomas oglekli, kas ir oksidēts karboksilgrupā.
Gomezol homologi ar vienu sānu ķēdi dod benzoskābi:
Homologi, kas satur divas sānu ķēdes, dod divu asu skābes:
5C 6 H 5-C2 H 5 + 12KMNO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12MNO 4 + 28H 2 O
5C 6 H 5 -CH 3 + 6KMNO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MNO 4 + 14H 2 O
Vienkāršots :
C 6 H 5 -CH 3 + 3O Kmno4.→ C 6 H 5 COOH + H 2 O
B) neitrālā un zema sārma līdz benzoskābes sāļiem
C 6 H 5 -CH 3 + 2KMNO 4 → C 6 H 5 COOK + k viņš + 2mno 2 + h 2 o
II.. Pievienošanās reakcija (grūtāk nekā alkenes)
1. Halogenēšana
C 6 H 6 + 3CL 2 H. ν → C 6 h 6 cl 6 (Hexakhlorcikloheksāns - Hexakhloran)
2. hidrogenēšana
C 6 h 6 + 3h 2 T. , Pt. vai Ni. → C 6 H 12 (cikloheksāns)
3. polimerizācija
III. Aizstāšanas reakcijas - jonu mehānisms (vieglāks nekā Alkanovs)
1. Halogenēšana -
a. ) Benzols
C 6 h 6 + cl 2 Alcl 3 → C 6 h 5 -cl + HCl (hlorbenzols)
C 6 h 6 + 6cl 2 T, alcl3→ C 6 CL 6 + 6HCL( hexakhlorbenzols.)
C 6 h 6 + br 2 T, fecl3→ C 6 H 5 -BR + HBR( brombenzene.)
b) benzola homologi apstarošanas vai apkures laikā
Ar ķīmiskajām īpašībām alkilgrupas ir līdzīgi alkāniem. Ūdeņradi atomi tos aizstāj ar halogēnu brīvā radikāļa mehānismā. Tāpēc, ja nav katalizatora, apkures vai UV apstarošanas laikā notiek radikāla aizvietošanas reakcija sānu ķēdē. Benzola gredzena ietekme uz alkila aizvietotājiem noved pie tā, ka vienmēr ir ūdeņraža atoms pie oglekļa atoma, kas tieši saistīta ar benzola gredzenu (oglekļa oglekļa).
1) C 6 H 5 -CH 3 + CL 2 H. ν → C 6 H 5 -CH 2 -CL + HCL
c) benzola homologi klātbūtnē katalizators
C 6 H 5 -CH 3 + CL 2 Alcl 3 → (orlas maisījums, atvasinājumu pāris) + HCl
2. IEGULDĪJUMS (ar slāpekļskābi)
C 6 H 6 + HO-NO 2 T, H2SO4→ C 6 H 5 -NO 2 + H 2 O
nitrobenzene - smarža mandele!
C 6 H 5 -CH 3 + 3HO-NO 2 T, H2SO4→ No H3 -C 6 H 2 (NO 2) 3 + 3H 2 O2,4,6-trinitrotroluole (tol, trotils)
Benzola un viņa homologu izmantošana
Benzols C 6 H 6 ir labs šķīdinātājs. Benzols kā piedeva uzlabo degvielas kvalitāti. Kalpo kā izejvielas, lai iegūtu daudzus aromātiskus organiskos savienojumus - Nitrobenzene C 6 H 5 Nr 2 (šķīdinātājs, anilīns tiek iegūts no tā), hlorbenzols c 6 h 5 cl, fenols c 6 h 5 Ak, stirola utt.
Toluols C 6 H 5 -CH 3 ir šķīdinātājs, ko izmanto krāsvielu, zāļu un sprāgstvielu ražošanā (trotila (TOL) vai 2,4,6-trinitrotrol slīpumā).
KsilolsC 6 H 4 (CH 3) 2. Tehniskais ksilēns - trīs izomēru maisījums ( orto-, meta- I. pāris-Xilolovs) - izmanto kā šķīdinātāju un avota produktu daudzu organisko savienojumu sintēzei.
Izopropilbenzols. C 6 H 5 -CH (CH 3) 2 kalpo, lai iegūtu fenolu un acetonu.
Hloro atvasinājumi Benzol Izmanto, lai aizsargātu augus. Tādējādi, aizvietošanas produkts benzīna atomiem n atomi hlora - heksahlorbenzols ar 6 cl 6 - fungicīdu; To izmanto sausiem kviešu sēklu kodināšanas un rudziem pret cieto galvu. Produkta pievienošana hlora uz benzolu - heksahlorcikloheksānu (heksahlororānu) ar 6 h 6 cl 6 - insekticīdu; To izmanto, lai cīnītos pret kaitīgiem kukaiņiem. Šīs vielas attiecas uz pesticīdiem - ķimikālijām, lai apkarotu mikroorganismus, augus un dzīvniekus.
Stirole C 6 H 5 - CH \u003d CH2 ir ļoti viegli polimerizēts, veidojot polistirolu un kopolimerāciju ar butadiēnu - butadienestrol gumiju.
Video eksperimenti




