Halo semuanya! Gadis-gadis yang pernah mengalami situasi serupa, tanggapi! Pemutaran pertama dilakukan pada 27 Mei. Pada USG, semuanya normal. Mereka menulis telepon untuk berjaga-jaga, tetapi saya tidak berharap mereka akan menelepon kembali, dan sekarang seminggu kemudian mereka menelepon - datang untuk rujukan ke cpsir, Anda memiliki risiko tinggi. Saya tidak ingat diri saya sendiri, dalam air mata, saya mengendarai kapas, mengambil semua kertas. Risiko 1:53. Keesokan harinya saya pergi untuk pemeriksaan tambahan. Uzist mencari dalam waktu yang sangat lama baik di perut maupun di vagina, beberapa kali menyalakan Doppler, dan semuanya tampak baik-baik saja, tetapi dia tidak menyukai DOPPLEROMETRI KATUP TRISKUPIDAL: PERATURAN. Saya memasukkan data scan USG baru ke dalam program dan dari hasil skrining seminggu yang lalu, komputer memberi resiko diabetes 1: 6. Dikirim ke ahli genetika. Setelah melihat kesimpulannya, dia menjelaskan kepada saya bahwa regurgitasi ini mungkin hanya ciri janin, tetapi ditambah dengan nilai PAPP-A yang diremehkan sebesar 0,232 MoM, ini adalah penanda kelainan kromosom. Segala sesuatu yang lain berada dalam kisaran normal. Mereka menawarkan untuk menjalani biopsi vilus korionik. Saya telah menolak sejauh ini, perawat hampir jatuh dari kursinya, seperti risikonya sangat tinggi dan HA tidak dirawat dan di tempat saya dia tidak akan berpikir sebentar. Saya bertanya kepada ahli genetika tentang analisis Panorama (analisis gen yang sangat mahal untuk darah ibu), dia menjawab bahwa tentu saja Anda dapat melakukannya, tetapi itu hanya mengecualikan 5 CA utama dan beberapa yang sangat langka, tidak dapat sepenuhnya mengesampingkan anomali, dan dalam kasus saya, invasi dianjurkan. Saya telah membaca banyak sekali artikel, pertanyaan, dan semua hal semacam itu tentang topik ini, dan saya sama sekali tidak mengerti apa yang menurut mereka sangat buruk dalam analisis saya? Regurgitasi, ternyata, bersifat fisiologis saat ini dan melewati 18-20 minggu (jika tidak kunjung sembuh, ini menunjukkan risiko cacat jantung, karena banyak yang lewat setelah melahirkan, dan beberapa masih hidup dan tidak. tidak mempengaruhi apa pun. katup minthral, \u200b\u200byang didapat dari ibu, mungkin entah bagaimana saling berhubungan). Hormon mungkin tidak menjadi indikasi sama sekali, karena Saya mengkonsumsi dyufaston sejak awal kehamilan, saya makan 2 jam sebelum analisis (ternyata 4 jam sebelumnya tidak boleh makan, mereka tidak memberi tahu saya), minum kopi, gugup dan khawatir tentang USG dan saya takut untuk mendonorkan darah, dan baru-baru ini kelelahan kronis, saya lelah dengan anak saya yang lebih tua. Dan semua ini mempengaruhi hasil. Ahli genetika tidak menanyakan hal semacam itu, tidak tertarik, mereka memiliki semacam konveyor di sana, dan seolah-olah saya didorong ke sana untuk statistik. Tapi mereka menanamkan sedikit keraguan pada saya, saya khawatir, tidak khawatir selama setahun sebelumnya. Sang suami membujuk untuk dilakukan biopsi. Saya sangat takut akan konsekuensinya, takut kehilangan atau menyakiti anak saya, terutama jika dia sehat. Di satu sisi, jika semuanya baik-baik saja, saya akan bernapas lega dan mengirim semua dokter pergi. Di sisi lain, jika semuanya buruk, apa yang harus dilakukan? Akankah saya dapat mengakhiri kehamilan, untuk membiarkan anak saya dipotong-potong di dalam diri saya, terutama sekarang ketika menurut saya saya mulai merasakannya. Tetapi pilihan lain adalah apakah saya dapat membesarkan seorang anak yang membutuhkan pendekatan khusus dan banyak perhatian, ketika kadang-kadang saya ingin melarikan diri dari seorang putri yang benar-benar sehat ... Sial, semua pikiran ini menggerogoti saya. Saya tidak tahu harus berbuat apa ... Untuk berjaga-jaga, saya akan memberikan data penyaringan:
Batas waktu: 13 minggu
Denyut jantung 161 denyut / menit
Duktus vena PI 1.160
Chorion / Planet rendah di dinding depan
Tali pusar 3 pembuluh
Anatomi janin: semuanya ditentukan, semuanya normal
b-hCG 1.091 MoM
PAPP-A 0.232 MoM
Arteri uteri PI 1.240 MoM
Trisomi 21 1: 6
Trisomi 18 1: 311
Trisomi 13 1: 205
Preeklamsia sampai 34 minggu b-t 1: 529
Preeklamsia sampai 37 minggu, b-t 1: 524
7.1. KLASIFIKASI DIABETES
Diabetes(DM) - sekelompok penyakit metabolik yang ditandai dengan hiperglikemia karena gangguan sekresi dan / atau efektivitas kerja insulin. Hiperglikemia kronis, yang berkembang pada diabetes, disertai dengan perkembangan komplikasi dari banyak organ dan sistem, terutama dari jantung, pembuluh darah, mata, ginjal, dan saraf. Sebanyak 5-6% penduduk menderita diabetes. Di negara maju secara ekonomi dunia, setiap 10-15 tahun, jumlah penderita diabetes meningkat 2 kali lipat. Harapan hidup pada diabetes berkurang 10-15%.
Penyebab diabetes melitus sangat bervariasi. Pada sebagian besar kasus, diabetes berkembang karena kekurangan insulin absolut (diabetes mellitus tipe 1 -CD-1), atau karena penurunan sensitivitas jaringan perifer terhadap insulin dalam kombinasi dengan disfungsi sekretorik sel β pankreas (diabetes mellitus tipe 2 -SD-2). Dalam beberapa kasus, sulit untuk mengklasifikasikan pasien sebagai SD-1 atau SD-2; namun, dalam praktiknya, kompensasi diabetes lebih signifikan daripada menetapkan jenisnya secara akurat. Klasifikasi etiologi mengidentifikasi empat kelas klinis utama diabetes (Tabel 7.1).
CD-1 yang paling umum (bagian 7.5), CD-2 (bagian 7.6) dan diabetes gestasional (bagian 7.9) dibahas dalam bab terpisah. Di jenis khusus lainnyamenyumbang hanya sekitar 1% dari kasus diabetes. Etiologi dan patogenesis jenis diabetes melitus ini tampaknya lebih banyak dipelajari dibandingkan dengan CD-1 dan terutama CD-2. Sejumlah varian diabetes disebabkan oleh keturunan secara monogen cacat genetik pada fungsiβ -sel.Ini mencakup berbagai varian sindrom MODY yang diturunkan secara dominan autosom (eng. kematangan timbulnya diabetes pada usia muda- diabetes tipe dewasa pada orang muda), yang ditandai dengan pelanggaran, tetapi bukan kurangnya sekresi insulin dengan sensitivitas normal jaringan perifer terhadapnya.
Tab. 7.1.Klasifikasi diabetes mellitus
Jarang sekali kasuistik cacat genetik dalam aksi insulin,terkait dengan mutasi reseptor insulin (leprechaunism, sindrom Rabson-Mandecholl). DM berkembang secara alami saat penyakit pankreas eksokrin,menyebabkan kerusakan sel-β (pankreatitis, pankreatektomi, fibrosis kistik, hemochromatosis), serta pada sejumlah penyakit endokrin di mana terjadi produksi hormon kontrainsuler yang berlebihan (akromegali, sindrom Cushing). Obat-obatan dan bahan kimia(vacor, pentamidine, nicotinic acid, diazoxide, dll.) jarang menyebabkan diabetes, tetapi dapat berkontribusi pada manifestasi dan dekompensasi penyakit pada orang dengan resistensi insulin. Baris penyakit menular(rubella, sitomegali, infeksi coxsackievirus dan adenovirus) dapat disertai dengan kerusakan sel β, sedangkan pada kebanyakan pasien penanda imunogenetik CD-1 ditentukan. UNTUK bentuk langka diabetes yang dimediasi oleh kekebalantermasuk diabetes, yang berkembang pada pasien dengan sindrom "kaku-rnan" (penyakit saraf autoimun), serta diabetes akibat paparan autoantibodi terhadap reseptor insulin. Berbagai jenis diabetes dengan frekuensi yang meningkat ditemukan di
banyak sindrom genetik, khususnya, dengan sindrom Down, Klinefelter, Turner, Wolfram, Prader-Willi dan sejumlah lainnya.
7.2. ASPEK KLINIS FISIOLOGI PERTUKARAN KARBOHIDRAT
Insulindisintesis dan disekresikan oleh sel β dari pulau pankreas Langerhans (PZH). Selain itu, pulau Langerhans mengeluarkan glukagon (sel α), somatostatin (sel δ) dan polipeptida pankreas (sel PP). Hormon sel pulau berinteraksi satu sama lain: glukagon biasanya merangsang sekresi insulin, dan somatostatin menekan sekresi insulin dan glukagon. Molekul insulin terdiri dari dua rantai polipeptida (rantai A - 21 asam amino; rantai B - 30 asam amino) (Gambar 7.1). Sintesis insulin dimulai dengan pembentukan preproinsulin, yang dibelah oleh suatu protease untuk membentuk proinsulin.Dalam butiran sekretori aparatus Golgi, proinsulin dipecah menjadi insulin dan C-peptida,yang dilepaskan ke dalam darah selama eksositosis (Gambar 7.2).
Stimulator utama sekresi insulin adalah glukosa. Pelepasan insulin terjadi sebagai respons terhadap peningkatan glukosa darah bifasik(gbr 7.3). Fase pertama, atau akut, berlangsung beberapa menit, dan ini terkait dengan pelepasan akumulasi
 Ara. 7.1.Diagram struktur utama molekul insulin
Ara. 7.1.Diagram struktur utama molekul insulin
 Ara. 7.2.Skema biosintesis insulin
Ara. 7.2.Skema biosintesis insulin
insulin dalam sel β di antara waktu makan. Fase kedua berlanjut hingga kadar glikemik mencapai puasa normal (3,3-5,5 mmol / L). Sediaan sulfonylurea bekerja dengan cara yang sama pada sel β.
Melalui sistem portal, insulin mencapai hati- organ target utamanya. Reseptor hati mengikat setengah dari hormon yang disekresikan. Separuh lainnya, memasuki sirkulasi sistemik, mencapai otot dan jaringan adiposa. Sebagian besar insulin (80%) mengalami degradasi proteolitik di hati, sisanya di ginjal, dan hanya sebagian kecil yang dimetabolisme langsung oleh otot dan sel lemak. Umur normal
 Ara. 7.3.Pelepasan insulin biphasik oleh glukosa
Ara. 7.3.Pelepasan insulin biphasik oleh glukosa
seorang dewasa mengeluarkan 35-50 U insulin per hari, yaitu 0,6-1,2 U per 1 kg berat badan. Sekresi ini dibagi lagi menjadi makanan dan basal. Sekresi makananinsulin sesuai dengan kenaikan kadar glukosa postprandial, mis. karena itu, netralisasi efek hiperglikemik makanan dipastikan. Jumlah insulin makanan kira-kira sesuai dengan jumlah karbohidrat yang dikonsumsi - sekitar 1-2,5 U.
untuk 10-12 g karbohidrat (1 unit roti - XE). Sekresi insulin basalmemastikan tingkat glikemia dan anabolisme yang optimal dalam interval antara waktu makan dan selama tidur. Insulin basal disekresikan dengan kecepatan sekitar 1 U / jam; dengan aktivitas fisik yang lama atau puasa yang berkepanjangan, itu menurun secara signifikan. Insulin makanan menyumbang setidaknya 50-70% dari produksi insulin harian (Gambar 7.4).
Sekresi insulin tidak hanya dipengaruhi oleh makanan, tetapi juga harian
 Ara. 7 .4.
Skema produksi insulin harian normal
Ara. 7 .4.
Skema produksi insulin harian normal
fluktuasi:kebutuhan insulin meningkat pada dini hari, dan kemudian secara bertahap menurun pada siang hari. Jadi, untuk sarapan untuk 1 XE, 2,0-2,5 U insulin disekresikan, untuk makan siang - 1,0-1,5 U, dan untuk makan malam - 1,0 U. Salah satu penyebab perubahan sensitivitas insulin ini adalah tingginya kadar sejumlah hormon kontrainsular (terutama kortisol) di pagi hari, yang berangsur-angsur turun ke minimum di awal malam.
Utama efek fisiologis insulinadalah stimulasi transfer glukosa melintasi membran sel jaringan yang bergantung pada insulin. Organ sasaran utama insulin adalah hati, jaringan adiposa, dan otot. Jaringan yang tidak bergantung insulin, suplai glukosa yang tidak bergantung pada efek insulin, terutama meliputi sistem saraf pusat dan perifer, endotel vaskular, sel darah, dll. Insulin menstimulasi sintesis glikogen di hati dan otot, sintesis lemak di hati dan jaringan adiposa, sintesis protein di hati, otot dan organ lainnya. Semua perubahan ini ditujukan untuk memanfaatkan glukosa, yang menyebabkan penurunan levelnya dalam darah. Antagonis insulin fisiologis adalah glukagon,yang merangsang mobilisasi glikogen dan lemak dari depot; Biasanya, kadar glukagon berbanding terbalik dengan produksi insulin.
Efek biologis insulin dimediasi oleh reseptor,yang terletak di sel target. Reseptor insulin adalah glikoprotein dari empat subunit. Dengan tingginya kadar insulin dalam darah, jumlah reseptornya menurun sesuai dengan prinsip downregulation, yang disertai dengan penurunan kepekaan sel terhadap insulin. Setelah insulin mengikat reseptor sel, kompleks yang terbentuk memasuki sel. Selanjutnya, di dalam sel otot dan lemak, insulin menyebabkan mobilisasi vesikula intraseluler yang mengandung pengangkut glukosaGLUT-4. Akibatnya, vesikel bergerak ke permukaan sel, di mana GLUT-4 bertindak sebagai saluran masuk glukosa. Latihan memiliki efek serupa pada GLUT-4.
7.3. DIAGNOSTIK LABORATORIUM DAN KRITERIA KOMPENSASI UNTUK DIABETES MELLITUS
Diagnosis laboratorium diabetes didasarkan pada penentuan kadar glukosa darah, sedangkan kriteria diagnostiknya sama untuk semua
jenis dan varian DM (Tabel 7.2). Data dari tes laboratorium lain (tingkat glukosuria, penentuan tingkat hemoglobin terglikasi) tidak boleh digunakan untuk memverifikasi diagnosis diabetes mellitus. Diagnosis diabetes melitus dapat ditegakkan atas dasar dua deteksi salah satunya tiga kriteria:
1. Dengan gejala diabetes yang jelas (poliuria, polidipsia) dan kadar glukosa dalam darah lengkap kapiler lebih dari 11,1 mmol / l, terlepas dari waktu makan dan waktu makan sebelumnya.
2. Ketika kadar glukosa darah kapiler pada saat perut kosong lebih dari 6,1 mmol / l.
3. Dengan kadar glukosa dalam darah utuh kapiler 2 jam setelah konsumsi 75 gram glukosa (tes toleransi glukosa oral) lebih dari 11,1 mmol / L.
Tab. 7.2.Kriteria diagnosis diabetes melitus
 Tes terpenting dan signifikan dalam mendiagnosis diabetes adalah menentukan kadar glukosa puasa (minimal puasa 8 jam). Di Federasi Rusia, kadar glikemik biasanya diukur dalam darah utuh. Pengujian glukosa banyak digunakan di banyak negara
Tes terpenting dan signifikan dalam mendiagnosis diabetes adalah menentukan kadar glukosa puasa (minimal puasa 8 jam). Di Federasi Rusia, kadar glikemik biasanya diukur dalam darah utuh. Pengujian glukosa banyak digunakan di banyak negara
dalam plasma darah. Tes toleransi glukosa oral(OGTT; penentuan kadar glukosa 2 jam setelah konsumsi 75 gram glukosa dilarutkan dalam air) dalam hal ini, kurang penting dilampirkan. Namun demikian, berdasarkan OGTT, itu didiagnosis toleransi glukosa terganggu(NTG). IGT didiagnosis jika kadar glukosa darah kapiler puasa tidak melebihi 6,1 mmol / L, dan 2 jam setelah pemuatan glukosa lebih tinggi dari 7,8 mmol / L, tetapi di bawah 11,1 mmol / L. Pilihan lain untuk pelanggaran metabolisme karbohidrat adalah gangguan glikemia puasa(NGNT). Yang terakhir ditentukan jika kadar glikemik darah kapiler utuh pada saat perut kosong berada dalam kisaran 5,6-6,0 mmol / l, dan 2 jam setelah pemuatan glukosa kurang dari 7,8 mmol / l). NTG dan NGNT saat ini digabungkan dengan istilah tersebut pradiabeteskarena kedua kategori pasien tersebut memiliki risiko tinggi manifestasi diabetes mellitus dan perkembangan makroangiopati diabetik.
Untuk diagnosis diabetes, kadar glikemik harus ditentukan dengan menggunakan metode laboratorium standar. Saat menafsirkan indikator glikemik, harus diingat bahwa pada saat perut kosong kadar glukosa dalam darah vena utuh sesuai dengan kadarnya dalam darah kapiler utuh. Setelah makan atau OGTT, kadarnya dalam darah vena kira-kira 1,1 mmol / l lebih rendah dari pada darah kapiler. Glukosa plasma kira-kira 0,84 mmol / L lebih tinggi dari darah utuh. Untuk menilai kompensasi dan kecukupan terapi diabetes, kadar glikemik dinilai dalam darah kapiler menggunakan portable glukometeroleh pasien itu sendiri, kerabat atau tenaga medis mereka.
Dengan semua jenis diabetes, serta dengan beban glukosa yang signifikan, glukosuria,yang merupakan konsekuensi dari melebihi ambang batas reabsorpsi glukosa dari urin primer. Ambang batas untuk reabsorpsi glukosa bervariasi secara signifikan secara individual (≈ 9-10 mmol / l). Glukosuria sebaiknya tidak digunakan sebagai indikator yang berdiri sendiri untuk diagnosis diabetes mellitus. Biasanya, kecuali dalam kasus makanan yang banyak mengandung karbohidrat olahan, glukosuria tidak terjadi.
Produk badan keton(aseton, asetoasetat, β-hidroksibutirat) diintensifkan secara signifikan dengan defisiensi insulin absolut. Dengan dekompensasi SD-1, diucapkan ketonuria(diselidiki menggunakan strip tes yang dicelupkan ke dalam urin). Ketonuria ringan (trace) dapat dideteksi pada orang sehat dengan puasa dan diet bebas karbohidrat.
Indikator laboratorium penting yang digunakan untuk diagnosis banding jenis diabetes, serta untuk mendeteksi pembentukan defisiensi insulin pada pasien diabetes mellitus-2, adalah level C-peptida.Dengan tingkat C-peptida dalam darah, seseorang secara tidak langsung dapat menilai kemampuan mensekresi insulin dari sel β pankreas. Yang terakhir menghasilkan proinsulin, dari mana C-peptida dibelah sebelum sekresi, yang memasuki aliran darah dalam jumlah yang sama dengan insulin. Insulin mengikat 50% di hati dan memiliki waktu paruh darah perifer sekitar 4 menit. C-peptida tidak dikeluarkan dari aliran darah oleh hati dan memiliki waktu paruh sekitar 30 menit. Selain itu, ia tidak mengikat reseptor seluler di pinggiran. Oleh karena itu, penentuan level C-peptida adalah tes yang lebih andal untuk menilai fungsi dari alat insular. Tingkat C-peptida paling informatif untuk diselidiki dengan latar belakang tes stimulasi (setelah makan atau pemberian glukagon). Tes ini tidak informatif jika dilakukan dengan latar belakang dekompensasi diabetes mellitus yang parah, karena hiperglikemia berat memiliki efek toksik pada sel β (toksisitas glukosa). Terapi insulin dalam beberapa hari sebelumnya tidak akan mempengaruhi hasil tes sama sekali.
Utama tujuan pengobatandari semua jenis diabetes adalah pencegahan komplikasinya yang lanjut, yang dapat dicapai dengan latar belakang kompensasi yang stabil untuk sejumlah parameter (Tabel 7.3). Kriteria utama kualitas kompensasi metabolisme karbohidrat pada diabetes adalah tingkat hemoglobin terglikasi (terglikosilasi) (HbA1c).Yang terakhir adalah hemoglobin, yang terikat secara non-kovalen dengan glukosa. Glukosa memasuki eritrosit secara independen dari insulin, dan glikosilasi hemoglobin adalah proses yang tidak dapat diubah, dan derajatnya berbanding lurus dengan konsentrasi glukosa yang bersentuhan dengannya selama 120 hari keberadaannya. Sebagian kecil hemoglobin mengalami glikosilasi dan normal; dengan diabetes, itu bisa meningkat secara signifikan. Kadar HbA1c, berbeda dengan kadar glukosa, yang terus berubah, secara integral mencerminkan glikemia selama 3-4 bulan terakhir. Dengan interval seperti itu dianjurkan untuk menentukan kadar HbA1c untuk menilai kompensasi diabetes mellitus.
Hiperglikemia kronis bukanlah satu-satunya faktor risiko untuk perkembangan dan perkembangan komplikasi diabetes lanjut. Tentang penilaian kompensasi SDberdasarkan kompleks
metode penelitian laboratorium dan instrumental (Tabel 7.3). Selain indikator yang mencirikan keadaan metabolisme karbohidrat, yang terpenting adalah tingkat tekanan darah dan spektrum lipid darah.
Tab. 7.3.Kriteria kompensasi diabetes
 Selain kriteria kompensasi di atas, perencanaan tujuan pengobatan diabetes memerlukan pendekatan individual. Kemungkinan perkembangan dan perkembangan komplikasi lanjut diabetes (terutama mikroangiopati) meningkat seiring dengan durasi penyakit. Jadi, jika pada anak-anak dan pasien muda, yang pengalaman diabetesnya mungkin mencapai beberapa dekade di masa depan, perlu untuk mencapai indikator glikemik yang optimal, kemudian pada pasien yang diabetes memanifestasikan dirinya di usia tua dan tua, kompensasi euglikemik parah, yang meningkat secara signifikan. risiko hipoglikemia, tidak selalu tepat.
Selain kriteria kompensasi di atas, perencanaan tujuan pengobatan diabetes memerlukan pendekatan individual. Kemungkinan perkembangan dan perkembangan komplikasi lanjut diabetes (terutama mikroangiopati) meningkat seiring dengan durasi penyakit. Jadi, jika pada anak-anak dan pasien muda, yang pengalaman diabetesnya mungkin mencapai beberapa dekade di masa depan, perlu untuk mencapai indikator glikemik yang optimal, kemudian pada pasien yang diabetes memanifestasikan dirinya di usia tua dan tua, kompensasi euglikemik parah, yang meningkat secara signifikan. risiko hipoglikemia, tidak selalu tepat.
7.4. PERSIAPAN INSULIN DAN TERAPI INSULIN
Sediaan insulin sangat penting untuk pasien diabetes mellitus-1; Selain itu, hingga 40% pasien diabetes mellitus menerimanya. Untuk umum indikasi penunjukan terapi insulin untuk diabetes,banyak yang sebenarnya tumpang tindih satu sama lain termasuk:
1. Diabetes melitus tipe 1
2. Pankreatektomi
3. Ketoasidosis dan koma hiperosmolar
4. Dengan diabetes tipe 2:
Tanda-tanda defisiensi insulin yang jelas, seperti penurunan berat badan dan ketosis yang progresif, hiperglikemia berat;
Intervensi bedah utama;
Komplikasi makrovaskuler akut (stroke, infark miokard, gangren, dll.) Dan penyakit infeksi berat, disertai dekompensasi metabolisme karbohidrat;
Tingkat glikemia puasa lebih dari 15-18 mmol / l;
Kurangnya kompensasi yang stabil, meskipun telah ditetapkan dosis harian maksimum berbagai obat antihiperglikemik tablet;
Stadium lanjut dari komplikasi lanjut diabetes (polineuropati dan retinopati berat, gagal ginjal kronis).
5. Kegagalan mencapai kompensasi untuk diabetes gestasional melalui terapi diet.
Berdasarkan asalsediaan insulin dapat diklasifikasikan menjadi tiga kelompok:
Insulin hewan (babi);
Insulin manusia (semi-sintetik, rekayasa genetika);
Analog insulin (lispro, aspart, glargine, detemir).
Kemajuan teknologi untuk produksi insulin manusia telah menyebabkan fakta bahwa penggunaan insulin babi(berbeda dari asam amino manusia satu per satu) baru-baru ini menurun secara signifikan. Insulin babi dapat digunakan untuk membuat insulin manusia metode semi-sintetis,yang melibatkan penggantian satu asam amino yang berbeda dalam molekulnya. Mereka memiliki kualitas terbaik rekayasa genetikainsulin manusia. Untuk mendapatkannya, wilayah genom manusia yang bertanggung jawab untuk sintesis insulin dikaitkan dengan genom E.coliatau kultur ragi, sebagai akibatnya yang terakhir mulai memproduksi insulin manusia. Makhluk analog insulindengan bantuan penataan ulang berbagai asam amino mengejar tujuan mendapatkan obat dengan farmakokinetik yang diberikan dan paling menguntungkan. Jadi, insulin lispro (Humalog) adalah analog
insulin kerja-ultrashort, sementara efek hipoglikemiknya berkembang sudah 15 menit setelah injeksi. Sebaliknya, insulin analog glargine (Lantus) ditandai dengan efek jangka panjang yang berlangsung sepanjang hari, sedangkan kekhasan kinetika obat tersebut adalah tidak adanya puncak yang diucapkan dalam konsentrasi plasma. Sebagian besar preparat insulin yang saat ini digunakan dan analognya diproduksi di konsentrasi100 U / ml. Oleh durasi aksiinsulin dibagi menjadi 4 kelompok utama (Tabel 7.4):
Tab. 7.4.Farmakokinetik obat dan analog insulin
 1.
Kerja ultra-pendek (lispro, aspart).
1.
Kerja ultra-pendek (lispro, aspart).
2. Akting pendek (insulin manusia sederhana).
3. Durasi aksi sedang (insulin pada protamin netral Hagedorn).
4. Bertindak panjang (glargine, detemir).
5. Campuran insulin dengan berbagai durasi kerja (Novomix-30, Humulin-MZ, Humalog-Mix-25).
Narkoba tindakan ultrashort[lispro (Humalog), aspart (Novorapid)] adalah analog insulin. Keuntungan mereka adalah perkembangan cepat efek hipoglikemik setelah injeksi (setelah 15 menit), yang memungkinkan untuk menyuntikkan segera sebelum makan atau bahkan segera setelah makan, serta durasi tindakan yang singkat (kurang dari 3 jam), yang mengurangi risiko hipoglikemia. Narkoba akting pendek(insulin sederhana, insulin biasa) adalah larutan yang mengandung insulin dengan konsentrasi 100 U / ml. Injeksi insulin sederhana dilakukan 30 menit sebelum makan; durasi tindakan sekitar 4-6 jam. Obat ultra-pendek dan kerja pendek dapat diberikan secara subkutan, intramuskular, dan intravena.
Diantara obat-obatan durasi menengahobat yang paling sering digunakan adalah Hagedorn's neutral protamine (NPH). NPH adalah protein yang mengadsorpsi insulin secara non-kovalen, memperlambat penyerapannya dari depot subkutan. Durasi kerja insulin NPH yang efektif biasanya sekitar 12 jam; mereka disuntikkan hanya secara subkutan. Insulin NPH adalah suspensi, dan oleh karena itu, tidak seperti insulin sederhana dalam botol, itu keruh, dan setelah berdiri lama, bentuk suspensi, yang harus dicampur secara menyeluruh sebelum injeksi. Insulin NPH, tidak seperti obat pelepasan-lama lainnya, dapat dicampur dengan insulin kerja-pendek (insulin sederhana) dalam rasio apapun, sedangkan farmakokinetik dari komponen campuran tidak akan berubah, karena NPH tidak akan mengikat jumlah tambahan insulin sederhana (Gbr. 7.5). Selain itu, protamin digunakan untuk membuat campuran standar analog insulin (Novomix-30, Humalog-Mix-25).
Di antara obat kerja panjang, analog insulin saat ini aktif digunakan. glargine(Lantus) dan detemir(Levemir). Fitur farmakokinetik yang menguntungkan dari obat ini adalah, tidak seperti insulin NPH, obat ini memberikan asupan obat yang lebih seragam dan jangka panjang dari depot subkutan. Dalam hal ini, glargine hanya dapat diresepkan sekali sehari, dan secara praktis terlepas dari waktu.
 Ara. 7.5.Farmakokokinetika berbagai sediaan insulin:
Ara. 7.5.Farmakokokinetika berbagai sediaan insulin:
a) komponen tunggal; b) campuran insulin standar
Selain sediaan insulin monokomponen, dalam praktik klinis banyak digunakan campuran standar.Biasanya, kita berbicara tentang campuran insulin pendek atau ultra-pendek dengan insulin kerja menengah. Misalnya, obat "Humulin-MZ" mengandung 30% insulin sederhana dan 70% insulin NPH dalam satu botol; obat "Novomix-30" mengandung 30% insulin aspart dan 70% suspensi protamin kristal dari insulin aspart; obat "Humalog-Mix-25" mengandung 25% insulin lispro dan 75% protamine suspensi dari insulin lispro. Keuntungan
campuran standar insulin adalah penggantian dua suntikan satu dan akurasi dosis komponen campuran sedikit lebih tinggi kerugiannya adalah ketidakmungkinan dosis individu dari masing-masing komponen campuran. Ini menentukan preferensi penggunaan campuran insulin standar untuk pengobatan DM-2 atau yang disebut terapi insulin tradisional(meresepkan insulin dosis tetap), sedangkan untuk terapi insulin intensif(pemilihan dosis yang fleksibel tergantung pada parameter glikemik dan jumlah karbohidrat dalam makanan), penggunaan sediaan monokomponen lebih disukai.
Kunci keberhasilan terapi insulin adalah kepatuhan yang ketat teknik injeksi.Ada beberapa cara untuk mengelola insulin. Metode paling sederhana dan paling andal adalah suntikan insulin. jarum suntik.Cara pemberian insulin yang lebih nyaman adalah dengan menggunakan suntikan pena jarum suntik,yang merupakan perangkat gabungan yang berisi reservoir insulin (kartrid), sistem dosis dan jarum injektor.
Untuk terapi pemeliharaan (ketika kita tidak berbicara tentang dekompensasi diabetes yang parah atau kondisi kritis), insulin disuntikkan secara subkutan. Dianjurkan untuk menyuntikkan insulin kerja pendek ke dalam jaringan lemak subkutan perut, sedangkan suntikan insulin tindakan berkepanjangan ke dalam jaringan paha atau bahu (Gbr. 7.6 a). Suntikan dilakukan jauh ke dalam jaringan subkutan melalui kulit yang dikompresi secara luas pada sudut 45 ° (Gbr. 7.6 b). Pasien harus disarankan untuk mengubah tempat suntikan insulin setiap hari di area yang sama untuk mencegah perkembangan lipodistrofi.
UNTUK faktor yang mempengaruhi tingkat penyerapan insulindari depot subkutan, dosis insulin harus dikaitkan (peningkatan dosis meningkatkan durasi penyerapan), tempat suntikan (penyerapan lebih cepat dari serat perut), suhu lingkungan (pemanasan dan pijat tempat suntikan mempercepat penyerapan).
Metode pemberian yang lebih kompleks, yang, bagaimanapun, memungkinkan banyak pasien untuk mencapai hasil pengobatan yang baik, adalah penggunaan dispenser insulin,atau sistem untuk pemberian insulin subkutan secara terus menerus. Dispenser adalah perangkat portabel yang terdiri dari komputer yang mengatur mode pengiriman insulin, serta sistem pengiriman insulin, yang dilakukan melalui kateter dan jarum suntik miniatur.
 Ara. 7.6.Suntikan insulin: a) tempat suntikan biasa; b) posisi jarum suntik insulin selama injeksi
Ara. 7.6.Suntikan insulin: a) tempat suntikan biasa; b) posisi jarum suntik insulin selama injeksi
jaringan adiposa. Dengan bantuan dispenser, pemberian basal secara terus menerus dari insulin kerja pendek atau kerja ultra pendek dilakukan (jumlahnya sekitar 0,5-1 U / jam), dan sebelum makan, tergantung pada kandungan karbohidrat dan tingkat glikemia, pasien memberikan dosis bolus yang diperlukan dari insulin kerja pendek yang sama. Keuntungan terapi insulin dengan dispenser adalah pengenalan hanya satu insulin aksi pendek (atau bahkan ultra-pendek), yang dengan sendirinya agak lebih fisiologis, karena penyerapan sediaan insulin yang berkepanjangan tunduk pada fluktuasi yang besar; dalam hal ini, pemberian insulin kerja pendek secara terus menerus tampaknya menjadi proses yang lebih dapat dikelola. Kerugian dari terapi insulin dengan dispenser adalah kebutuhan untuk terus menerus memakai alat tersebut, serta adanya jarum suntik jangka panjang di jaringan subkutan, yang membutuhkan pemantauan berkala dari proses pengiriman insulin. Terapi insulin dengan dispenser diindikasikan terutama untuk pasien CD-1 yang sudah siap menguasai teknik pemberiannya. Khususnya dalam hal ini, perhatian harus diberikan kepada pasien dengan fenomena "fajar pagi", serta pasien hamil dan berencana hamil dengan diabetes mellitus dan pasien.
orang dengan gaya hidup yang tidak teratur (kemungkinan diet yang lebih fleksibel).
7.5. DIABETES TIPE 1
SD-1 - khusus organ autoimunpenyakit yang menyebabkan kerusakan sel β penghasil insulin di pulau pankreas, yang dimanifestasikan oleh defisiensi insulin absolut. Dalam beberapa kasus, pasien dengan CD-1 yang jelas tidak memiliki penanda kerusakan sel β autoimun (idiopatik CD-1).
Etiologi
CD-1 adalah penyakit dengan kecenderungan turun-temurun, tetapi kontribusinya terhadap perkembangan penyakit kecil (menentukan perkembangannya sekitar 1 / jam). Konkordansi pada kembar identik SD-1 hanya 36%. Kemungkinan mengembangkan DM-1 pada anak dengan ibu yang sakit adalah 1-2%, untuk ayah - 3-6%, untuk saudara laki-laki atau perempuan - 6%. Satu atau lebih penanda humoral kerusakan autoimun pada sel β, yang meliputi antibodi terhadap pulau pankreas, antibodi terhadap glutamat dekarboksilase (GAD65) dan antibodi terhadap tirosin fosfatase (IA-2 dan ΙΑ-2β), ditemukan di 85- 90% pasien ... Namun demikian, peran utama dalam penghancuran sel β diberikan pada faktor imunitas seluler. CD-1 dikaitkan dengan haplotipe HLA seperti DQAdan DQB,dengan beberapa alel HLA-DR / DQmungkin mempengaruhi perkembangan penyakit, sementara yang lain bersifat protektif. Dengan frekuensi yang meningkat, CD-1 dikombinasikan dengan endokrin autoimun lainnya (tiroiditis autoimun, penyakit Addison) dan penyakit non-endokrin seperti alopesia, vitiligo, penyakit Crohn, penyakit rematik (Tabel 7.5).
Patogenesis
CD-1 memanifestasikan dirinya ketika 80-90% sel β dihancurkan oleh proses autoimun. Kecepatan dan intensitas proses ini dapat sangat bervariasi. Paling sering dengan kursus biasapenyakit pada anak-anak dan remaja, proses ini berlangsung agak cepat, diikuti oleh manifestasi penyakit yang hebat, di mana hanya beberapa minggu dapat berlalu dari munculnya gejala klinis pertama hingga perkembangan ketoasidosis (hingga koma ketoasidosis).
Tab. 7.5.Diabetes melitus tipe 1
 Kelanjutan tabel. 7.5
Kelanjutan tabel. 7.5
 Dalam kasus lain yang jauh lebih jarang, biasanya pada orang dewasa di atas usia 40 tahun, penyakit ini bisa bersifat laten. (diabetes autoimun laten pada orang dewasa - LADA),pada saat yang sama, pada permulaan penyakit, pasien tersebut sering didiagnosis dengan DM-2, dan selama beberapa tahun, kompensasi untuk DM dapat dicapai dengan meresepkan sulfonilurea. Namun kedepannya, biasanya setelah 3 tahun, ada tanda-tanda defisiensi insulin absolut (penurunan berat badan, ketonuria, hiperglikemia berat, meski sudah minum obat antidiabetik pil).
Dalam kasus lain yang jauh lebih jarang, biasanya pada orang dewasa di atas usia 40 tahun, penyakit ini bisa bersifat laten. (diabetes autoimun laten pada orang dewasa - LADA),pada saat yang sama, pada permulaan penyakit, pasien tersebut sering didiagnosis dengan DM-2, dan selama beberapa tahun, kompensasi untuk DM dapat dicapai dengan meresepkan sulfonilurea. Namun kedepannya, biasanya setelah 3 tahun, ada tanda-tanda defisiensi insulin absolut (penurunan berat badan, ketonuria, hiperglikemia berat, meski sudah minum obat antidiabetik pil).
Patogenesis CD-1, seperti yang ditunjukkan, didasarkan pada defisiensi insulin absolut. Ketidakmampuan glukosa untuk memasuki jaringan yang bergantung pada insulin (adiposa dan otot) menyebabkan kekurangan energi, akibatnya lipolisis dan proteolisis diintensifkan, yang berhubungan dengan penurunan berat badan. Peningkatan kadar glikemia menyebabkan hiperosmolaritas, yang disertai diuresis osmotik dan dehidrasi berat. Dalam kondisi defisiensi insulin dan defisiensi energi, produksi hormon kontrainsular (glukagon, kortisol, hormon pertumbuhan) dihambat, yang meskipun terjadi peningkatan glikemia, menyebabkan stimulasi glukoneogenesis. Peningkatan lipolisis pada jaringan adiposa menyebabkan peningkatan konsentrasi asam lemak bebas yang signifikan. Dengan kekurangan insulin, kemampuan liposintetik hati ditekan, dan
asam lemak mulai terlibat dalam ketogenesis. Akumulasi badan keton menyebabkan perkembangan ketosis diabetik, dan di masa depan - ketoasidosis. Dengan peningkatan progresif dehidrasi dan asidosis, koma berkembang (lihat klausul 7.7.1), yang jika tidak ada terapi insulin dan rehidrasi pasti berakhir dengan kematian.
Epidemiologi
DM-1 menyumbang sekitar 1,5-2% dari semua kasus diabetes, dan indikator relatif ini selanjutnya akan menurun karena peningkatan yang cepat dalam kejadian DM-2. Risiko seumur hidup untuk mengembangkan CD-1 pada ras kulit putih adalah sekitar 0,4%. Insiden DM-1 meningkat 3% per tahun: sebesar 1,5% - karena kasus baru dan 1,5% lainnya - karena peningkatan harapan hidup pasien. Prevalensi CD-1 bervariasi tergantung pada komposisi etnis penduduk. Pada tahun 2000, 0,02% di Afrika, 0,1% di Asia Selatan, serta di Amerika Selatan dan Tengah, dan 0,2% di Eropa dan Amerika Utara. Kejadian DM-1 tertinggi ada di Finlandia dan Swedia (30-35 kasus per 100 ribu penduduk per tahun), dan terendah di Jepang, China dan Korea (masing-masing 0,5-2,0 kasus). Puncak usia manifestasi SD-1 kira-kira 10-13 tahun. Pada sebagian besar kasus, CD-1 muncul sebelum usia 40 tahun.
Manifestasi klinis
DI kasus tipikal,terutama pada anak-anak dan remaja, CD-1 muncul dengan gambaran klinis yang jelas yang berkembang selama beberapa bulan atau bahkan berminggu-minggu. Manifestasi CD-1 dapat dipicu oleh penyakit menular dan penyakit lain yang menyertai. Apakah karakteristik gejala umum untuk semua jenis diabetes,terkait dengan hiperglikemia: polidipsia, poliuria, pruritus, tetapi dengan CD-1 sangat terasa. Jadi, sepanjang hari, pasien bisa minum dan mengeluarkan cairan hingga 5-10 liter. Spesifikuntuk CD-1, gejalanya, yang disebabkan oleh kekurangan insulin absolut, adalah penurunan berat badan, mencapai 10-15 kg selama 1-2 bulan. Ditandai dengan kelemahan umum dan otot yang parah, penurunan kinerja, kantuk. Pada permulaan penyakit, beberapa pasien mungkin mengalami peningkatan nafsu makan, yang digantikan oleh anoreksia seiring berkembangnya ketoasidosis. Yang terakhir ini ditandai dengan munculnya bau aseton (atau bau buah) dari mulut,
perhatikan, muntah, sering nyeri perut (pseudoperitonitis), dehidrasi hebat dan diakhiri dengan berkembangnya koma (lihat hal. 7.7.1). Dalam beberapa kasus, manifestasi pertama CD-1 pada anak-anak adalah gangguan kesadaran yang progresif hingga koma dengan latar belakang penyakit penyerta, biasanya patologi bedah infeksi atau akut.
Dalam kasus yang relatif jarang terjadi perkembangan CD-1 pada orang berusia di atas 35-40 tahun (diabetes autoimun laten pada orang dewasa)penyakit ini dapat memanifestasikan dirinya dengan kurang jelas (polidipsia dan poliuria sedang, tidak ada penurunan berat badan) dan bahkan dapat dideteksi secara kebetulan selama penentuan rutin kadar glikemik. Dalam kasus ini, pasien sering didiagnosis dengan diabetes mellitus-2 di awal, dan obat antihiperglikemik tablet (TSP) diresepkan, yang untuk beberapa waktu memberikan kompensasi yang dapat diterima untuk diabetes. Namun demikian, selama beberapa tahun (seringkali dalam satu tahun), pasien mengalami gejala akibat defisiensi insulin absolut yang terus meningkat: penurunan berat badan, ketidakmampuan untuk mempertahankan glikemia normal dengan latar belakang TSP, ketosis, dan ketoasidosis.
Diagnostik
Mengingat bahwa CD-1 memiliki gambaran klinis yang jelas, dan juga merupakan penyakit yang relatif jarang, penentuan skrining dari tingkat glikemia untuk mendiagnosis CD-1 tidak ditampilkan. Kemungkinan mengembangkan penyakit pada kerabat terdekat pasien rendah, yang, bersama dengan kurangnya metode pencegahan primer CD-1 yang efektif, membuat studi penanda imunogenetik penyakit di dalamnya menjadi tidak bijaksana. Diagnosis CD-1 pada sebagian besar kasus didasarkan pada identifikasi hiperglikemia yang signifikan pada pasien dengan manifestasi klinis yang parah dari defisiensi insulin absolut. OGTT untuk diagnosis diabetes mellitus-1 sangat jarang dilakukan.
Perbedaan diagnosa
Dalam kasus yang meragukan (identifikasi hiperglikemia sedang dengan tidak adanya manifestasi klinis yang jelas, manifestasi pada usia yang relatif paruh baya), serta untuk tujuan diagnosis banding dengan jenis diabetes lain, tingkat C-peptida(basal dan 2 jam setelah makan). Nilai diagnostik tidak langsung dalam kasus yang meragukan mungkin memiliki definisi penanda imunologiCD-1 - antibodi terhadap pulau-pulau kecil
PLL, menjadi glutamat dekarboksilase (GAD65) dan tirosin fosfatase (IA-2 dan IA-2β). Diagnosis banding CD-1 dan CD-2 disajikan pada tabel. 7.6.
Tab. 7.6.Diagnosis banding dan perbedaan antara CD-1 dan CD-2
 Pengobatan
Pengobatan
Pengobatan semua jenis diabetes didasarkan pada tiga prinsip utama: terapi hipoglikemik (dengan diabetes-1 - terapi insulin), diet dan pendidikan pasien. Terapi insulindengan SD-1 keausan karakter penggantidan tujuannya adalah untuk memaksimalkan peniruan produksi fisiologis hormon untuk mencapai kriteria kompensasi yang diterima (Tabel 7.3). Sekresi fisiologis insulin adalah yang terdekat terapi insulin intensif.Kebutuhan insulin sesuai dengan kebutuhannya sekresi basal,diberikan dengan dua suntikan insulin kerja-sedang (pagi dan sore) atau satu suntikan insulin kerja-panjang (glargine). Dosis total insulin basal
lina tidak boleh melebihi setengah dari total kebutuhan harian untuk obat tersebut. Sekresi insulin nutrisi atau bolusdiganti dengan suntikan insulin kerja pendek atau kerja ultra pendek sebelum makan, sedangkan dosisnya dihitung berdasarkan jumlah karbohidrat yang seharusnya dikonsumsi selama makan yang akan datang, dan tingkat glikemia saat ini, ditentukan oleh pasien menggunakan glukometer sebelum setiap injeksi insulin (Gbr.7.7).
Indikatif rejimen terapi insulin intensif,yang akan berubah hampir setiap hari, dapat direpresentasikan sebagai berikut. Diasumsikan bahwa kebutuhan insulin harian adalah sekitar 0,5-0,7 U per 1 kg berat badan (untuk pasien dengan berat badan 70 kg, sekitar 35-50 U). Sekitar 1/3 - 1/2 dari dosis ini adalah insulin kerja panjang (20-25 U), 1/2 - 2/3 insulin kerja pendek atau insulin kerja ultra pendek. Dosis insulin NPH dibagi menjadi 2 suntikan: di pagi hari 2/3 dari dosisnya (12 U), di malam hari - 1/3 (8-10 U).
Tujuan tahap pertamapilihan terapi insulin adalah normalisasi kadar glukosa puasa. Dosis insulin NPH malam biasanya diberikan pada pukul 10-23 malam, pada pagi hari bersamaan dengan injeksi insulin kerja pendek sebelum sarapan pagi. Saat memilih dosis malam insulin NPH, perlu diingat kemungkinan pengembangan sejumlah
 Ara. 7.7.Regimen terapi insulin intensif
Ara. 7.7.Regimen terapi insulin intensif
fenomena yang cukup khas. Penyebab hiperglikemia pagi hari mungkin karena dosis insulin kerja lama yang tidak mencukupi, karena pada pagi hari kebutuhan insulin meningkat secara signifikan. (fenomena "fajar pagi").Selain dosis yang tidak mencukupi, kelebihannya dapat menyebabkan hiperglikemia pagi - fenomena Somoji(Somogyi), hiperglikemia pasca hipoglikemik. Fenomena ini dijelaskan oleh fakta bahwa sensitivitas maksimum jaringan terhadap insulin diamati antara jam 2 dan 4 pagi. Pada saat inilah tingkat hormon kontrinsuler utama (kortisol, hormon pertumbuhan, dll.) Biasanya paling rendah. Jika dosis malam insulin pelepasan berkepanjangan berlebihan, maka saat ini berkembang hipoglikemia.Secara klinis, ini dapat memanifestasikan dirinya sebagai kurang tidur dengan mimpi buruk, tindakan tidak sadar saat tidur, sakit kepala di pagi hari, dan kelelahan. Perkembangan hipoglikemia saat ini menyebabkan pelepasan kompensasi yang signifikan dari glukagon dan hormon counterinsular lainnya, diikuti oleh hiperglikemia di pagi hari.Jika, dalam situasi ini, dosis insulin kerja lama yang diberikan di malam hari tidak dikurangi, tetapi dosis insulin kerja lama yang diberikan di malam hari meningkat, hipoglikemia nokturnal dan hiperglikemia pagi hari akan memburuk, yang pada akhirnya dapat menyebabkan penyakit kronis. sindrom overdosis insulin (sindrom Somoji), yang merupakan kombinasi antara obesitas dengan dekompensasi kronis diabetes mellitus, sering hipoglikemia, dan komplikasi lanjut yang progresif. Untuk mendiagnosis fenomena Somoji, perlu dilakukan studi tingkat glikemia sekitar pukul 3 pagi, yang merupakan komponen integral dari pemilihan terapi insulin. Jika penurunan dosis NPH malam menjadi aman dalam hal perkembangan hipoglikemia nokturnal disertai hiperglikemia pada pagi hari (fenomena subuh pagi), pasien disarankan untuk bangun lebih awal (6-7 pagi), sedangkan insulin yang diberikan pada malam hari masih terus mempertahankan tingkat glikemia yang normal.
Suntikan kedua insulin NPH biasanya diberikan sebelum sarapan, bersama dengan suntikan pagi insulin kerja pendek (ultra-pendek). Dalam hal ini, dosis dipilih terutama berdasarkan indikator tingkat glikemia sebelum makan utama sehari-hari (makan siang, makan malam); Selain itu, dapat dibatasi oleh perkembangan hipoglikemia pada interval antara waktu makan, misalnya pada siang hari, antara sarapan dan makan siang.
Dosis insulin utuh tindakan berkepanjangan(glargine) diberikan sekali sehari, dan tidak peduli jam berapa. Kinetika
insulin glargine dan detemir lebih menguntungkan dalam hal risiko hipoglikemia, termasuk hipoglikemia nokturnal.
Dosis insulin kerja pendek atau kerja ultra pendek bahkan pada hari pertama pemberian insulin pasien akan bergantung pada jumlah karbohidrat (unit roti) yang dikonsumsi dan tingkat glikemia sebelum injeksi. Secara konvensional, berdasarkan ritme sirkadian normal sekresi insulin, sekitar 1/4 dari dosis insulin kerja-pendek (6-8 U) dikonsumsi untuk makan malam, sisa dosis dibagi kira-kira sama untuk sarapan dan makan siang (10-12 U) ). Semakin tinggi tingkat glikemik awal, semakin sedikit penurunannya per unit insulin yang diberikan. Suntikan insulin kerja pendek diberikan 30 menit sebelum makan, insulin kerja ultra pendek segera sebelum makan, atau bahkan segera setelah makan. Kecukupan dosis insulin kerja pendek dinilai dengan indikator glikemik 2 jam setelah makan dan sebelum makan berikutnya.
Untuk menghitung dosis insulin untuk terapi insulin intensif, cukup menghitung jumlah XE, hanya berdasarkan komponen karbohidrat. Dalam hal ini, tidak semua makanan yang mengandung karbohidrat diperhitungkan, tetapi hanya yang dihitung yang dihitung. Yang terakhir termasuk kentang, biji-bijian, buah-buahan, produk susu cair dan makanan manis. Makanan yang mengandung karbohidrat yang tidak dapat dicerna (kebanyakan sayuran) tidak termasuk dalam penghitungan. Tabel pertukaran khusus telah dikembangkan, dengan bantuan yang mengungkapkan jumlah karbohidrat dalam XE, dimungkinkan untuk menghitung dosis insulin yang diperlukan. Satu XE sama dengan 10-12 g karbohidrat (Tabel 10.7).
Setelah makan yang mengandung 1 XE, kadar glikemik meningkat 1,6-2,2 mmol / l, mis. tentang sebanyak penurunan kadar glukosa dengan pengenalan 1 U insulin. Dengan kata lain, untuk setiap XE yang terkandung dalam makanan yang direncanakan untuk dimakan, perlu dimasukkan terlebih dahulu (tergantung waktu) sekitar 1 U insulin. Selain itu, perlu memperhitungkan hasil swa-monitor tingkat glikemia, yang dilakukan sebelum setiap injeksi, dan waktu hari (sekitar 2 unit insulin untuk 1 XE di pagi hari dan saat makan siang, 1 unit untuk 1 XE - untuk makan malam). Jadi, jika terdeteksi hiperglikemia, dosis insulin yang dihitung sesuai dengan waktu makan yang akan datang (sesuai nomor XE) harus ditingkatkan, dan sebaliknya, jika terdeteksi hipoglikemia, lebih sedikit insulin yang diberikan.
Tab. 7.7.Produk pengganti setara yang membentuk 1 XE
 Misalnya, jika pasien memiliki kadar glikemik 7 mmol / L 30 menit sebelum makan malam yang direncanakan mengandung 5 XE, ia perlu menyuntikkan 1 U insulin agar glikemia-nya turun ke tingkat normal: dari 7 mmol / L menjadi sekitar 5 mmol / l. Selain itu, 5 U insulin harus disuntikkan ke lapisan 5 XE. Dengan demikian, pasien dalam kasus ini akan menyuntikkan 6 U insulin kerja pendek atau insulin kerja ultra pendek.
Misalnya, jika pasien memiliki kadar glikemik 7 mmol / L 30 menit sebelum makan malam yang direncanakan mengandung 5 XE, ia perlu menyuntikkan 1 U insulin agar glikemia-nya turun ke tingkat normal: dari 7 mmol / L menjadi sekitar 5 mmol / l. Selain itu, 5 U insulin harus disuntikkan ke lapisan 5 XE. Dengan demikian, pasien dalam kasus ini akan menyuntikkan 6 U insulin kerja pendek atau insulin kerja ultra pendek.
Setelah manifestasi CD-1 dan dimulainya terapi insulin untuk waktu yang cukup lama, kebutuhan insulin mungkin kecil dan kurang dari 0,3-0,4 U / kg. Periode ini disebut sebagai fase remisi, atau "Bulan madu".Setelah periode hiperglikemia dan ketoasidosis, yang menekan sekresi insulin hingga 10-15% dari sel β yang tersisa, kompensasi gangguan metabolisme hormonal dengan pemberian insulin memulihkan fungsi sel-sel ini, yang kemudian mengambil alih fungsi tersebut. tubuh dengan insulin pada tingkat minimum. Periode ini dapat berlangsung dari beberapa minggu hingga beberapa tahun, tetapi pada akhirnya, karena kerusakan autoimun dari sel β yang tersisa, bulan madu berakhir.
Dietdengan DM-1 pada pasien terlatih yang memiliki keterampilan pengendalian diri dan pemilihan dosis insulin, dapat diliberalisasi, mis. mendekati gratis. Jika pasien tidak kelebihan berat badan atau kekurangan berat badan, diet harus dilakukan
isocaloric. Komponen utama makanan dengan CD-1 adalah karbohidrat, yang seharusnya mencapai sekitar 65% dari asupan kalori harian. Makanan yang mengandung karbohidrat kompleks dan lambat menyerap, serta makanan yang kaya serat makanan harus diutamakan. Makanan yang mengandung karbohidrat yang mudah dicerna (tepung, manis) harus dihindari. Proporsi protein harus dikurangi menjadi 10-35%, yang membantu mengurangi risiko pengembangan mikroangiopati, dan proporsi lemak - hingga 25-35%, sementara membatasi lemak harus mencakup hingga 7% kalori, yang mana mengurangi risiko aterosklerosis. Selain itu, Anda harus menghindari minuman beralkohol, terutama yang kuat.
Komponen integral bekerja dengan pasien dengan CD-1 dan kunci kompensasi efektifnya adalah pendidikan pasien.Sepanjang hidupnya, pasien harus setiap hari secara mandiri, tergantung pada banyak faktor, mengubah dosis insulin. Tentunya, ini membutuhkan kemahiran dalam keterampilan tertentu yang perlu diajarkan kepada pasien. "Sekolah untuk pasien dengan SD-1" diselenggarakan di rumah sakit endokrinologi atau rawat jalan dan terdiri dari 5-7 sesi terstruktur di mana dokter atau perawat terlatih khusus dalam mode interaktif menggunakan berbagai alat bantu visual mengajarkan prinsip kepada pasien kontrol diri.
Ramalan cuaca
Dengan tidak adanya terapi insulin, pasien dengan CD-1 pasti meninggal karena koma ketoasidosis. Dengan terapi insulin yang tidak memadai, dengan latar belakang kriteria kompensasi diabetes tidak tercapai dan pasien berada dalam keadaan hiperglikemia kronis (Tabel 7.3), komplikasi lanjut mulai berkembang dan berkembang (Bagian 7.8). Pada DM-1, manifestasi mikroangiopati diabetik (nefropati dan retinopati) dan neuropati (sindrom kaki diabetik) merupakan signifikansi klinis terbesar dalam hal ini. Makroangiopati pada DM-1 relatif jarang muncul.
7.6. TIPE 2 DIABETES
Diabetes melitus tipe 2- penyakit kronis yang dimanifestasikan oleh pelanggaran metabolisme karbohidrat dengan perkembangan hiperglikemia karena resistensi insulin dan disfungsi sekresi sel β,
serta metabolisme lipid dengan perkembangan aterosklerosis. Karena penyebab utama kematian dan kecacatan pada pasien adalah komplikasi aterosklerosis sistemik, CD-2 terkadang disebut penyakit kardiovaskular.
Tab. 7.8.Diabetes melitus tipe 2
 Etiologi
Etiologi
DM-2 adalah penyakit multifaktorial dengan kecenderungan turun-temurun. Konkordansi menurut SD-2 pada kembar identik mencapai 80% atau lebih. Kebanyakan pasien dengan DMT2 menunjukkan adanya DMT2 di keluarga terdekat mereka; dengan adanya CD-2 di salah satu orang tua, kemungkinan perkembangannya pada keturunannya sepanjang hidup adalah 40%. Gen tunggal, polimorfisme yang menentukan kecenderungan untuk CD-2, belum ditemukan. Faktor lingkungan, pertama-tama, fitur gaya hidup, memainkan peran besar dalam realisasi kecenderungan turun-temurun terhadap CD-2. Faktor risiko pengembangan DM-2 adalah:
Obesitas, terutama obesitas viseral (lihat item 11.2);
Etnisitas (terutama saat mengubah cara hidup tradisional ke Barat);
Gaya hidup menetap;
Fitur diet (asupan tinggi karbohidrat olahan dan kandungan serat rendah);
Hipertensi arteri.
Patogenesis
Secara patogenesis, CD-2 adalah kelompok kelainan metabolisme yang heterogen, dan inilah yang menentukan heterogenitas klinisnya yang signifikan. Patogenesisnya didasarkan pada resistensi insulin (penurunan penggunaan glukosa yang dimediasi oleh insulin oleh jaringan), yang direalisasikan dengan latar belakang disfungsi sekretorik sel β. Dengan demikian, terjadi ketidakseimbangan dalam sensitivitas insulin dan sekresi insulin. Disfungsi sekretoriβ -seladalah memperlambat pelepasan sekresi "awal" insulin sebagai respons terhadap peningkatan kadar glukosa darah. Dalam hal ini, fase sekresi pertama (cepat), yang terdiri dari pengosongan vesikula dengan akumulasi insulin, hampir tidak ada; Fase kedua (lambat) sekresi dilakukan sebagai respons terhadap stabilisasi hiperglikemia secara konstan, dalam mode tonik, dan, meskipun sekresi insulin berlebihan, tingkat glikemia dengan latar belakang resistensi insulin tidak menjadi normal (Gbr. 7.8) .
Konsekuensi dari hiperinsulinemia adalah penurunan sensitivitas dan jumlah reseptor insulin, serta penekanan
mekanisme pasca reseptor yang memediasi efek insulin (resistensi insulin).Kandungan transporter glukosa utama dalam sel otot dan lemak (GLUT-4) berkurang 40% pada orang dengan obesitas viseral dan 80% pada penderita diabetes mellitus-2. Karena resistensi insulin pada hepatosit dan hiperinsulinemia portal, hiperproduksi glukosa oleh hati,dan berkembangnya hiperglikemia puasa, yang terdeteksi pada sebagian besar pasien diabetes melitus, termasuk pada tahap awal penyakit.
Dengan sendirinya, hiperglikemia mempengaruhi sifat dan tingkat aktivitas sekresi sel-β (toksisitas glukosa) secara negatif. Jangka panjang, selama bertahun-tahun dan dekade, hiperglikemia yang ada pada akhirnya menyebabkan penipisan produksi insulin oleh sel β dan pasien mungkin mengalami beberapa gejala. defisiensi insulin- penurunan berat badan, ketosis dengan penyakit menular yang menyertai. Namun demikian, produksi insulin sisa, yang cukup untuk mencegah ketoasidosis, hampir selalu dipertahankan dalam DMT2.
Epidemiologi
SD-2 menentukan epidemiologi diabetes secara umum, karena ini menyumbang sekitar 98% kasus penyakit ini. Prevalensi DMT2 bervariasi antar negara dan kelompok etnis. Di Eropa
 Ara. 7.8.Disfungsi sekretorik sel β pada diabetes mellitus tipe 2 (hilangnya sekresi insulin fase cepat pertama)
Ara. 7.8.Disfungsi sekretorik sel β pada diabetes mellitus tipe 2 (hilangnya sekresi insulin fase cepat pertama)
negara, Amerika Serikat dan Federasi Rusia, itu adalah sekitar 5-6% dari populasi. Dengan bertambahnya usia, kejadian DM-2 meningkat: pada orang dewasa, prevalensi DM-2 adalah 10%, pada orang di atas 65 mencapai 20%. Insiden CD-2 2,5 kali lebih tinggi di antara penduduk asli Amerika dan Hawaii; di antara orang Indian dari suku Pima (Arizona), jumlahnya mencapai 50%. Di antara penduduk pedesaan di India, Cina, Chili dan negara-negara Afrika yang menjalani gaya hidup tradisional, prevalensi CD-2 sangat rendah (kurang dari 1%). Di sisi lain, ini mencapai tingkat yang signifikan di antara para imigran ke negara-negara industri Barat. Dengan demikian, di antara imigran dari India dan China yang tinggal di Amerika Serikat dan Inggris Raya, prevalensi CD-2 mencapai 12-15%.
WHO memprediksi peningkatan jumlah penderita diabetes di dunia sebesar 122% selama 20 tahun ke depan (dari 135 menjadi 300 juta). Hal ini disebabkan oleh penuaan populasi yang progresif dan penyebaran serta eksaserbasi gaya hidup urban. Dalam beberapa tahun terakhir, telah terjadi "peremajaan" CD-2 yang signifikan dan peningkatan kejadiannya di antara anak-anak.
Manifestasi klinis
Umumnya, tidak ada manifestasi klinis yang nyata,dan diagnosis dibuat dengan tes glukosa darah rutin. Penyakit ini biasanya bermanifestasi sendiri pada usia di atas 40 tahun, sementara sebagian besar pasien mengalami obesitas dan komponen sindrom metabolik lainnya (lihat paragraf 11.2). Pasien tidak akan mengeluhkan kinerja yang menurun jika tidak ada alasan lain untuk ini. Keluhan haus dan poliuria jarang mencapai keparahan yang berarti. Seringkali, pasien khawatir akan gatal pada kulit dan vagina, dan oleh karena itu mereka beralih ke dokter kulit dan ginekolog. Karena bertahun-tahun sering berlalu dari manifestasi CD-2 yang sebenarnya ke diagnosis (rata-rata, sekitar 7 tahun), pada banyak pasien, pada saat penyakit dideteksi, gambaran klinis didominasi oleh gejala dan manifestasi komplikasi lanjut diabetes.Terlebih lagi, kunjungan pertama pasien diabetes melitus-2 untuk pertolongan medis sangat sering terjadi sehubungan dengan komplikasi lanjut. Jadi, pasien bisa dirawat di rumah sakit bedah dengan ulkus kaki. (sindrom kaki diabetik),hubungi dokter mata sehubungan dengan penurunan penglihatan yang progresif (retinopati diabetik),dirawat di rumah sakit karena serangan jantung, stroke
tami, lesi yang menghancurkan pembuluh kaki di institusi tempat mereka pertama kali mengalami hiperglikemia.
Diagnostik
Kriteria diagnostik yang umum untuk semua jenis diabetes disajikan dalam klausul 7.3. Diagnosis CD-2 pada sebagian besar kasus didasarkan pada deteksi hiperglikemia pada orang dengan tanda klinis khas CD-2 (obesitas, usia di atas 40-45 tahun, riwayat keluarga CD-2 yang positif, komponen lain sindrom metabolik), dengan tidak adanya tanda klinis dan laboratorium defisiensi insulin absolut (penurunan berat badan yang ditandai, ketosis). Kombinasi dari prevalensi tinggi DM-2, karakteristik perjalanan asimtomatik jangka panjangnya dan kemungkinan mencegah komplikasi parahnya, tergantung pada diagnosis dini, menentukan kebutuhan untuk penyaringan,itu. melakukan survei untuk menyingkirkan CD-2 di antara orang-orang yang tidak memiliki gejala penyakit apa pun. Tes utama, seperti yang ditunjukkan, adalah menentukan kadar glukosa darah puasa.Ini ditunjukkan dalam situasi berikut:
1. Pada semua orang yang berusia di atas 45 tahun, terutama dengan berat badan berlebih (BMI di atas 25 kg / m 2) dengan interval setiap 3 tahun.
2. Pada usia yang lebih muda dengan adanya kelebihan berat badan (BMI lebih dari 25 kg / m2) dan tambahan faktor resiko, yang meliputi:
Gaya hidup menetap;
SD-2 dari keluarga terdekat;
Milik kebangsaan dengan risiko tinggi mengembangkan T2DM (Afrika Amerika, Hispanik, Pribumi Amerika, dll.);
Wanita yang pernah melahirkan anak dengan berat lebih dari 4 kg dan / atau dengan riwayat diabetes gestasional;
Hipertensi arteri (≥ 140/90 mm Hg);
HDL\u003e 0,9 mmol / L dan / atau trigliserida\u003e 2,8 mmol / L;
Sindrom ovarium polikistik;
NTG dan NGNT;
Penyakit kardiovaskular.
Peningkatan yang signifikan dalam kejadian DM-2 di antara anak-anak menentukan kebutuhan skrining untuk penentuan tingkat glikemia di kalangan anak-anak dan remaja(dimulai dari 10 tahun dengan selang waktu 2 tahun atau dengan permulaan
pubertas, jika terjadi pada usia yang lebih dini), termasuk dalam kelompok berisiko tinggi, termasuk anak-anak kegemukan(BMI dan / atau berat badan\u003e persentil ke-85 untuk usia, atau berat badan lebih dari 120% dari berat badan ideal) dalam kombinasi dengan dua faktor risiko tambahan berikut ini:
SD-2 di antara kerabat garis kekerabatan pertama atau kedua;
Etnis berisiko tinggi;
Manifestasi klinis berhubungan dengan resistensi insulin (acanthosis nigricans,hipertensi arteri, dislipidemia);
Diabetes melitus, termasuk diabetes gestasional, pada ibu.
Perbedaan diagnosa
Signifikansi klinis terbesar adalah diagnosis banding CD-2 dan CD-1, yang prinsipnya dijelaskan dalam klausul 7.5 (Tabel 7.6). Seperti yang diindikasikan, dalam banyak kasus ini didasarkan pada data klinis. Dalam kasus di mana sulit untuk menentukan jenis diabetes, atau ada kecurigaan beberapa varian langka diabetes, termasuk dalam rangka sindrom herediter, pertanyaan praktis terpenting yang perlu dijawab adalah apakah pasien memerlukan terapi insulin. .
Pengobatan
Komponen utama pengobatan DM-2 adalah: terapi diet, peningkatan aktivitas fisik, terapi hipoglikemik, pencegahan dan pengobatan komplikasi lanjut diabetes. Karena sebagian besar pasien DM-2 mengalami obesitas, diet harus ditujukan pada penurunan berat badan (hipokalorik) dan pencegahan komplikasi lanjut, terutama makroangiopati (aterosklerosis). Diet rendah kaloridiperlukan untuk semua pasien dengan berat badan berlebih (BMI 25-29 kg / m2) atau obesitas (BMI\u003e 30 kg / m2). Dalam kebanyakan kasus, dianjurkan untuk mengurangi asupan kalori harian menjadi 1000-1200 kkal untuk wanita dan 1200-1600 kkal untuk pria. Rasio komponen makanan utama yang direkomendasikan untuk CD-2 sama dengan rasio CD-1 (karbohidrat - 65%, protein 10-35%, lemak hingga 25-35%). Menggunakan alkoholharus dibatasi karena itu adalah sumber kalori tambahan yang signifikan, selain itu, asupan alkohol dengan latar belakang
pI dengan obat sulfonylurea dan insulin dapat memicu perkembangan hipoglikemia (lihat klausul 7.7.3).
Rekomendasi untuk peningkatan aktivitas fisikharus bersifat individual. Pada awalnya, latihan aerobik (berjalan, berenang) dengan intensitas sedang dianjurkan, berlangsung 30-45 menit 3-5 kali sehari (sekitar 150 menit seminggu). Di masa depan, diperlukan peningkatan aktivitas fisik secara bertahap, yang secara signifikan berkontribusi pada penurunan dan normalisasi berat badan. Selain itu, aktivitas fisik membantu mengurangi resistensi insulin dan memiliki efek hipoglikemik. Kombinasi terapi diet dan peningkatan aktivitas fisik tanpa meresepkan obat antihiperglikemik memungkinkan Anda untuk mempertahankan kompensasi diabetes sesuai dengan tujuan yang ditetapkan (Tabel 7.3) pada sekitar 5% pasien diabetes mellitus-2.
Persiapan untuk terapi antihiperglikemikdengan SD-2 dapat dibagi lagi menjadi empat kelompok utama.
I. Obat yang membantu mengurangi resistensi insulin (sensitizer).Kelompok ini termasuk metformin dan thiazolidinediones. Metforminadalah satu-satunya obat yang saat ini digunakan dari grup biguanides.Komponen utama dari mekanisme kerjanya adalah:
1. Penekanan glukoneogenesis di hati (penurunan produksi glukosa oleh hati), yang menyebabkan penurunan kadar glukosa puasa.
2. Penurunan resistensi insulin (peningkatan penggunaan glukosa oleh jaringan perifer, terutama otot).
3. Aktivasi glikolisis anaerobik dan pengurangan penyerapan glukosa di usus kecil.
Metforminmerupakan obat pilihan pertama untuk terapi antihiperglikemik pada pasien diabetes melitus, obesitas dan hiperglikemia puasa. Dosis awal adalah 500 mg sebelum tidur atau dengan makan malam. Kedepannya, dosis ditingkatkan secara bertahap menjadi 2-3 gram untuk 2-3 dosis. Di antara efek sampingnya, gejala dispepsia (diare) relatif umum, yang biasanya bersifat sementara dan hilang dengan sendirinya setelah 1-2 minggu mengonsumsi obat. Karena metformin tidak memiliki efek stimulasi pada produksi insulin, hipoglikemia tidak terjadi selama monoterapi dengan obat ini.
berkembang (aksinya disebut sebagai antihiperglikemik, dan bukan sebagai hipoglikemik). Kontraindikasi pengangkatan metformin adalah kehamilan, gagal jantung parah, hati, ginjal dan organ lainnya, serta kondisi hipoksia dari genesis lainnya. Komplikasi yang sangat jarang terjadi saat meresepkan metformin tanpa memperhitungkan kontraindikasi di atas adalah asidosis laktat, yang merupakan konsekuensi dari hiperaktivasi glikolisis anaerobik.
Thiazolidinediones(pioglitazone, rosiglitazone) adalah agonis reseptor aktif proliferator peroksisom (PPAR-γ). Thiazolidinediones mengaktifkan metabolisme glukosa dan lipid di otot dan jaringan adiposa, yang mengarah pada peningkatan aktivitas insulin endogen, mis. Untuk menghilangkan resistensi insulin (pemeka insulin). Dosis harian pioglitazone adalah 15-30 mg / hari, rosiglitazone adalah 4-8 mg (untuk 1-2 dosis). Kombinasi thiazolidinediones dengan metformin sangat efektif. Kontraindikasi penunjukan thiazolidinediones adalah peningkatan (2,5 kali atau lebih) pada tingkat transaminase hati. Selain hepatotoksisitas, efek samping tiazolidinedion termasuk retensi cairan dan edema, yang lebih sering terjadi jika obat digabungkan dengan insulin.
II. Obat mempengaruhiβ -sel dan mempromosikan sekresi insulin.Kelompok ini mencakup sediaan sulfonilurea dan glinida (pengatur prandial glikemia), yang digunakan terutama untuk menormalkan tingkat glikemia setelah makan. Target utamanya persiapan sulfonylurea(PSM) adalah sel β dari pulau pankreas. PSM mengikat membran sel β dengan reseptor spesifik. Hal ini menyebabkan penutupan saluran kalium yang bergantung pada ATP dan depolarisasi membran sel, yang pada gilirannya berkontribusi pada pembukaan saluran kalsium. Asupan kalsium ke dalam sel β menyebabkan degranulasi dan pelepasan insulin ke dalam darah. Dalam praktik klinis, banyak PSM digunakan, yang berbeda dalam durasi dan tingkat keparahan efek antihiperglikemik (Tabel 7.9).
Tab. 7.9.Sediaan Sulfonylurea
 Efek samping SCI yang utama dan cukup umum adalah hipoglikemia (lihat bagian 7.7.3). Dapat terjadi dengan overdosis obat, penumpukannya (gagal ginjal),
Efek samping SCI yang utama dan cukup umum adalah hipoglikemia (lihat bagian 7.7.3). Dapat terjadi dengan overdosis obat, penumpukannya (gagal ginjal),
ketidakpatuhan dengan diet (melewatkan makan, minum alkohol) atau rejimen (aktivitas fisik yang signifikan, sebelum dosis PSM tidak dikurangi atau karbohidrat tidak dikonsumsi).
Untuk grup glinides(regulator glikemik prandial) termasuk repaglinide(turunan asam benzoat; dosis harian 0,5-16 mg / hari) dan nateglinide.dll(Derivatif D-fenilalanin; dosis harian 180-540 mg / hari). Setelah pemberian, obat dengan cepat dan reversibel berinteraksi dengan reseptor sulfonylurea pada sel β, mengakibatkan peningkatan singkat dalam kadar insulin yang meniru fase pertama sekresi dalam kondisi normal. Obat diminum 10-20 menit sebelum makan utama, biasanya 3 kali sehari.
AKU AKU AKU. Obat yang mengurangi penyerapan glukosa di usus.
Kelompok ini termasuk acarbose dan guar gum. Mekanisme aksi acarbose adalah blokade α-glikosidase usus kecil yang dapat dibalik, sebagai akibatnya proses fermentasi dan penyerapan karbohidrat berurutan melambat, laju resorpsi dan pasokan glukosa ke hati menurun, dan tingkat glikemia postprandial menurun. Dosis awal acarbose adalah 50 mg 3 kali sehari, kedepan dosis dapat ditingkatkan menjadi 100 mg 3 kali sehari; obat tersebut diminum segera sebelum makan atau dengan makan. Efek samping utama acarbose adalah dispepsia usus (diare, perut kembung), yang berhubungan dengan asupan karbohidrat yang tidak terserap ke dalam usus besar. Efek penurun gula dari acarbose sangat moderat (Tabel 7.10).
Dalam praktik klinis, obat antihiperglikemik tablet dikombinasikan secara efektif satu sama lain dan dengan sediaan insulin, karena hiperglikemia puasa dan postprandial ditentukan secara bersamaan pada kebanyakan pasien. Ada banyak sekali kombinasi tetapobat dalam satu tablet. Paling sering, metformin digabungkan dalam satu tablet dengan berbagai PSM, serta metformin dengan tiazolidinedion.
Tab. 7.10.Mekanisme Kerja dan Potensi Efektivitas Obat Antidiabetik Tablet
 IV. Insulin dan analog insulin
IV. Insulin dan analog insulin
Pada tahap tertentu, hingga 30-40% pasien DM-2 mulai menerima sediaan insulin. Indikasi terapi insulin pada DM-2 diberikan di awal klausul 7.4. Pilihan paling umum untuk memindahkan pasien dengan diabetes mellitus-2 ke terapi insulin adalah meresepkan insulin kerja lama (insulin NPH, glargine, atau detemir) dalam kombinasi dengan obat antihiperglikemik tablet yang diminum. Dalam situasi di mana kadar glukosa puasa tidak dapat dikontrol dengan pengangkatan metformin atau yang terakhir dikontraindikasikan, pasien diberi resep suntikan insulin malam (pada malam hari). Jika tidak mungkin untuk mengontrol glikemia puasa dan postprandial dengan bantuan sediaan tablet, pasien dipindahkan ke terapi monoinsulin. Biasanya, dengan CD-2, terapi insulin dilakukan sesuai dengan yang disebut Skema "tradisional",yang menyiratkan penunjukan dosis tetap insulin kerja panjang dan kerja pendek. Dalam rencana ini
campuran standar yang nyaman dari insulin yang mengandung insulin dalam satu vial pendek (ultrashort) dan tindakan yang berkepanjangan. Pilihan terapi insulin tradisional ditentukan oleh fakta bahwa dalam kasus diabetes mellitus-2 sering diresepkan untuk pasien lanjut usia, yang sulit belajar mengubah dosis insulin secara mandiri. Selain itu, terapi insulin intensif, yang bertujuan untuk mempertahankan kompensasi metabolisme karbohidrat pada tingkat yang mendekati normoglikemia, meningkatkan risiko hipoglikemia. Sementara hipoglikemia ringan tidak menimbulkan ancaman serius bagi pasien muda, pada pasien lanjut usia dengan penurunan ambang batas sensasi hipoglikemia, mereka dapat memiliki efek yang sangat merugikan pada sistem kardiovaskular. Pasien muda dengan diabetes mellitus-2, serta pasien yang menjanjikan dalam hal kemungkinan pendidikan yang efektif, dapat diberikan varian intensif dari terapi insulin.
Ramalan cuaca
Penyebab utama kecacatan dan kematian pada pasien dengan DM-2 adalah komplikasi lanjut (lihat bagian 7.8), paling sering makroangiopati diabetik. Risiko terjadinya komplikasi akhir tertentu ditentukan oleh kompleks faktor yang dibahas dalam bab-bab terkait. Hiperglikemia kronis merupakan faktor risiko universal untuk perkembangannya. Dengan demikian, penurunan 1% pada tingkat HbA1c pada pasien dengan DM-2 menyebabkan penurunan mortalitas keseluruhan sekitar 20%, masing-masing sebesar 2% dan 3% - sekitar 40%.
7.7. KOMPLIKASI AKUT DIABETES MELLITUS
7.7.1. Ketoasidosis diabetik
Ketoasidosis diabetik (DKA)- dekompensasi CD-1, karena defisiensi absolut insulin, tanpa pengobatan tepat waktu, berakhir dengan koma ketoasidosis (CC) dan kematian.
Etiologi
DKA disebabkan oleh defisiensi insulin absolut. Satu atau beberapa tingkat keparahan DKA ditentukan pada kebanyakan pasien pada saat manifestasi CD-1 (10-20% dari semua kasus DKA).
Pada pasien dengan diagnosis CD-1 yang mapan, DKA dapat berkembang ketika pemberian insulin dihentikan, seringkali oleh pasien sendiri (13% dari kasus DKA), dengan latar belakang penyakit penyerta, terutama infeksi, dengan tidak adanya peningkatan. dalam dosis insulin
Tab. 7.11.Ketoasidosis diabetik
 Hingga 20% kasus perkembangan DKA pada pasien muda dengan T1DM dikaitkan dengan masalah psikologis dan / atau gangguan makan (takut bertambahnya berat badan, takut hipoglikemia, masalah remaja). Penyebab DKA yang cukup umum di sejumlah negara adalah
Hingga 20% kasus perkembangan DKA pada pasien muda dengan T1DM dikaitkan dengan masalah psikologis dan / atau gangguan makan (takut bertambahnya berat badan, takut hipoglikemia, masalah remaja). Penyebab DKA yang cukup umum di sejumlah negara adalah
penarikan insulin oleh pasien sendiri karena mahalnya harga obat untuk beberapa segmen populasi (Tabel 7.11).
Patogenesis
Patogenesis DKA didasarkan pada defisiensi insulin absolut yang dikombinasikan dengan peningkatan produksi hormon counterinsular seperti glukagon, katekolamin, dan kortisol. Akibatnya, terjadi peningkatan produksi glukosa yang signifikan oleh hati dan pelanggaran penggunaannya oleh jaringan perifer, peningkatan hiperglikemia dan pelanggaran osmolaritas ruang ekstraseluler. Kekurangan insulin dalam kombinasi dengan kelebihan relatif hormon kontrainsuler di DKA menyebabkan pelepasan asam lemak bebas ke dalam sirkulasi (lipolisis) dan oksidasi tak terkendali di hati menjadi badan keton (β-hidroksibutirat, asetoasetat, aseton), sebagai akibat dari yang berkembang menjadi hiperketonemia, dan selanjutnya asidosis metabolik. Sebagai akibat dari glukosuria berat, diuresis osmotik, dehidrasi, kehilangan natrium, kalium, dan elektrolit lain berkembang (Gbr. 7.9).
Epidemiologi
Frekuensi kasus baru DKA adalah 5-8 per 1000 pasien diabetes mellitus per tahun dan secara langsung tergantung pada tingkat penyelenggaraan perawatan medis bagi pasien diabetes. Sekitar 100.000 rawat inap untuk DKA terjadi setiap tahun di Amerika Serikat, dengan memperhitungkan biaya rawat inap sebesar $ 13.000 per pasien, lebih dari $ 1 miliar dihabiskan setiap tahun untuk pengobatan rawat inap DKA. Di Federasi Rusia pada tahun 2005, DKA tercatat pada 4,31% anak-anak, 4,75% remaja dan 0,33% pasien dewasa dengan diabetes mellitus-1.
Manifestasi klinis
Perkembangan DKA, tergantung pada penyebab yang menyebabkannya, bisa memakan waktu dari beberapa minggu sampai satu hari. Dalam kebanyakan kasus, DKA didahului oleh gejala dekompensasi diabetes, tetapi terkadang tidak berkembang seiring waktu. Gejala klinis DKA termasuk poliuria, polidipsia, penurunan berat badan, nyeri perut difus ("pseudoperitonitis diabetik"), dehidrasi, kelemahan parah, bau aseton dari mulut (atau bau buah), dan kesadaran bertahap kabur. Koma sejati dengan DKA baru-baru ini berkembang relatif jarang karena diagnosis dini. Pemeriksaan fisik menunjukkan tanda-tanda dehidrasi:
 Ara. 7.9. Patogenesis koma ketoasidosis
Ara. 7.9. Patogenesis koma ketoasidosis
turgor kulit dan kepadatan bola mata, takikardia, hipotensi. Dalam kasus lanjut, nafas Kussmaul berkembang. Lebih dari 25% pasien dengan DKA mengalami muntah, yang mungkin menyerupai warna bubuk kopi.
Diagnostik
Berdasarkan data klinis, indikasi adanya CD-1 pada pasien, serta data laboratorium. DKA ditandai dengan hiperglikemia (dalam beberapa kasus tidak signifikan), ketonuria, asidosis metabolik, hiperosmolaritas (Tabel 7.12).
Tab. 7.12.Diagnosis laboratorium komplikasi akut diabetes mellitus
 Saat memeriksa pasien dengan diabetes dekompensasi akut, perlu untuk menentukan tingkat glikemia, kreatinin dan urea, elektrolit, yang menjadi dasar penghitungan osmolaritas efektif. Selain itu, penilaian keadaan asam basa diperlukan. Osmolaritas efektif(EO) dihitung menggunakan rumus berikut: 2 *. Biasanya, EO adalah 285 - 295 mOsm / l.
Saat memeriksa pasien dengan diabetes dekompensasi akut, perlu untuk menentukan tingkat glikemia, kreatinin dan urea, elektrolit, yang menjadi dasar penghitungan osmolaritas efektif. Selain itu, penilaian keadaan asam basa diperlukan. Osmolaritas efektif(EO) dihitung menggunakan rumus berikut: 2 *. Biasanya, EO adalah 285 - 295 mOsm / l.
Pada kebanyakan pasien dengan DKA, leukositosis,tingkat keparahannya sebanding dengan tingkat badan keton dalam darah. Tingkat sodium,sebagai aturan, itu berkurang karena aliran osmotik cairan dari ruang intraseluler ke ruang ekstraseluler sebagai respons terhadap hiperglikemia. Lebih jarang, kadar natrium dapat diturunkan secara salah sebagai konsekuensi dari hiper-
trigliseridemia. Tingkat kaliumserum awalnya dapat meningkat karena pergerakannya dari ruang ekstraseluler.
Perbedaan diagnosa
Penyebab lain hilangnya kesadaran pada penderita diabetes. Diagnosis banding dengan koma hiperosmolar, sebagai aturan, tidak menimbulkan kesulitan (berkembang pada pasien lanjut usia dengan diabetes mellitus) dan tidak memiliki banyak signifikansi klinis, karena prinsip pengobatan untuk kedua kondisi tersebut serupa. Jika tidak mungkin untuk segera mengetahui alasan hilangnya kesadaran pasien diabetes, ia ditunjukkan pengenalan glukosa, karena keadaan hipoglikemik jauh lebih umum, dan dinamika positif yang cepat dengan latar belakang pemberian glukosa itu sendiri memungkinkan untuk mengetahui penyebab hilangnya kesadaran.
Pengobatan
Pengobatan DKA meliputi rehidrasi, koreksi hiperglikemia, gangguan elektrolit, dan pengobatan penyakit yang menyebabkan dekompensasi diabetes. Perawatan paling optimal harus dilakukan di unit perawatan intensif dari institusi medis khusus. Pada pasien dewasa tanpa patologi jantung bersamaan yang parah, bahkan pada tahap pra-rumah sakit, sebagai tindakan prioritas pertama untuk tujuan pengobatan. rehidrasidianjurkan untuk memasukkan larutan isotonik (0,9% NaCl) dengan kecepatan perkiraan satu liter per jam (sekitar 15-20 ml per kilogram berat per jam). Penggantian penuh untuk defisiensi cairan, yang dengan DKA adalah 100-200 ml per kg berat badan, harus dicapai dalam hari pertama pengobatan. Dengan gagal jantung atau ginjal bersamaan, periode waktu ini harus ditingkatkan. Untuk anak-anak, volume larutan isotonik yang dianjurkan untuk terapi rehidrasi adalah 10-20 ml per kg berat badan per jam, sedangkan untuk 4 jam pertama tidak boleh melebihi 50 ml per kg berat badan. Rehidrasi total direkomendasikan setelah sekitar 48 jam. Setelah, dengan latar belakang terapi insulin paralel, tingkat glikemia menurun menjadi sekitar 14 mmol / l, mereka beralih ke transfusi larutan glukosa 10%, yang melanjutkan rehidrasi.
Konsep "dosis kecil" kini telah diadopsi insulindalam pengobatan DKA. Hanya insulin kerja pendek yang digunakan. Penggunaan insulin intravena yang paling optimal
lina. Pemberian insulin intramuskular, yang kurang efektif, hanya mungkin dilakukan dengan DKA dengan tingkat keparahan sedang, dengan hemodinamik yang stabil dan ketidakmungkinan terapi intravena. Dalam kasus terakhir, suntikan dilakukan ke dalam otot rektus abdominis, sementara jarum suntik intramuskular diletakkan pada jarum suntik insulin (untuk injeksi intramuskular yang andal), dan melalui jarum ini insulin ditarik dari vial ke dalam semprit.
Ada beberapa pilihan untuk pemberian insulin intravena. Pertama, insulin dapat disuntikkan "ke dalam karet gelang" dari sistem infus, sedangkan jumlah insulin yang dibutuhkan ditarik ke dalam jarum suntik insulin, setelah itu 1 ml larutan isotonik dimasukkan ke dalamnya. Sampai tingkat glikemik mencapai 14 mmol / L, pasien disuntik setiap jam dengan 6-10 U insulin kerja pendek; lebih lanjut (bersamaan dengan mengubah larutan rehidrasi dari isotonik menjadi 10% glukosa)tergantung pada parameter glikemik yang diukur setiap jam, dosis insulin dikurangi menjadi 4-8 U per jam. Tingkat penurunan glikemik yang direkomendasikan tidak boleh melebihi 5 mmol / L per jam. Pilihan lain untuk terapi insulin intravena melibatkan penggunaan perfuser. Untuk menyiapkan larutan bagi pembuat parfum, satu hasil dari rasio: 2 ml larutan 20% albumin manusia ditambahkan ke 50 U insulin kerja pendek, setelah itu ditambahkan larutan isotonik 0,9% sebanyak 50 mg. Jika rute intramuskular pemberian insulin dipilih, awalnya 20 U insulin kerja pendek disuntikkan, setelah itu 6 U per jam, dan setelah mencapai tingkat glikemik 14 mmol / l, dosisnya dikurangi menjadi 4 U per jam. Setelah hemodinamik sepenuhnya stabil dan kompensasi gangguan asam basa, pasien dipindahkan ke suntikan insulin subkutan.
Sesuai indikasi, meski signifikan kekurangan kaliumdalam tubuh (kehilangan total 3-6 mmol / kg), dengan DKA, levelnya sebelum dimulainya terapi insulin mungkin sedikit meningkat. Namun, dianjurkan untuk memulai transfusi larutan kalium klorida bersamaan dengan terapi insulin jika kadar kalium plasma kurang dari 5,5 mmol / L. Koreksi defisiensi kalium yang berhasil hanya terjadi dengan latar belakang normalisasi pH. Pada pH rendah, asupan kalium ke dalam sel berkurang secara signifikan, oleh karena itu, jika memungkinkan, disarankan untuk menyesuaikan dosis kalium klorida yang ditransfusikan dengan indikator pH tertentu (Tabel 7.13).
Tab. 7.13.Skema koreksi kekurangan kalium
 * Data berikut digunakan untuk penghitungan:
* Data berikut digunakan untuk penghitungan:
1 g KCl \u003d 13,4 mmol; 1 mmol KCl \u003d 0,075 g Dalam larutan 4% KC1: dalam 100 ml - 4 g KC1, dalam 25 ml - 1 g KC1, dalam 10 ml 0,4 g KC1.
Dekompensasi diabetes sering disebabkan oleh penyakit menular(pielonefritis, ulkus yang terinfeksi dengan sindrom kaki diabetik, pneumonia, sinusitis, dll.). Ada aturan, yang menurutnya, dengan DKA, terapi antibiotik diresepkan untuk hampir semua pasien dengan kondisi subfebrile atau demam, bahkan jika tidak ada fokus infeksi yang terlihat, karena peningkatan suhu tubuh tidak khas untuk DKA.
Ramalan cuaca
Kematian di DKA adalah 0,5-5%, dengan sebagian besar kasus karena perawatan medis yang terlambat dan tidak terampil. Kematian tertinggi (hingga 50%) di antara pasien usia lanjut.
7.7.2. Koma hiperosmolar
Koma hiperosmolar(GOK) adalah komplikasi akut langka dari DM-2, yang berkembang sebagai akibat dari dehidrasi berat dan hiperglikemia dengan latar belakang tidak adanya defisiensi insulin absolut, disertai dengan mortalitas yang tinggi (Tabel 7.14).
Etiologi
HOC biasanya berkembang pada pasien usia lanjut dengan diabetes tipe 2. Pasien seperti itu paling sering kesepian, hidup tanpa perawatan, mengabaikan kondisi dan pengendalian diri mereka, dan tidak minum cukup cairan. Infeksi (sindrom kaki diabetik, pneumonia, pielonefritis akut), gangguan otak sering menyebabkan dekompensasi.
sirkulasi darah dan kondisi lain, akibat pergerakan pasien yang buruk, jangan minum obat dan cairan antihiperglikemik.
Tab. 7.14.Koma hiperosmolar (HOC)
 Patogenesis
Patogenesis
Peningkatan hiperglikemia dan diuresis osmotik menyebabkan dehidrasi parah, yang karena alasan di atas tidak terisi kembali dari luar. Hiperglikemia dan dehidrasi menyebabkan hiperosmolaritas plasma. Komponen integral dari patogenesis GOK adalah defisiensi relatif insulin dan kelebihan hormon kontra-insular; Namun, sekresi insulin sisa yang bertahan dengan DMT2 cukup untuk menekan lipolisis dan ketogenesis, sebagai akibatnya perkembangan ketoasidosis tidak terjadi.
Dalam beberapa kasus, asidosis sedang dapat ditentukan sebagai akibat dari hiperlaktatemia dengan latar belakang hipoperfusi jaringan. Dengan hiperglikemia parah, untuk menjaga keseimbangan osmotik dalam cairan serebrospinal, kandungan natrium meningkat, yang berasal dari sel-sel otak, tempat pertukaran kalium. Potensi transmembran sel saraf terganggu. Mengalami pengaburan kesadaran yang progresif dalam kombinasi dengan sindrom kejang (Gbr. 7.10).
Epidemiologi
GOK menyumbang 10-30% dari kondisi hiperglikemik akut pada orang dewasa dan pasien lanjut usia dengan diabetes mellitus. Pada sekitar 2/3 kasus, HOC berkembang pada orang dengan diabetes yang tidak terdiagnosis sebelumnya.
Manifestasi klinis
Gambaran klinis dari hiperosmolar koma adalah:
Kompleks tanda dan komplikasi dehidrasi dan hipoperfusi: haus, selaput lendir kering, takikardia, hipotensi arteri, mual, kelemahan, syok;
Kejang fokal dan umum;
Demam, mual dan muntah (40-65% kasus);
Dari penyakit dan komplikasi yang menyertai, trombosis vena dalam, pneumonia, kecelakaan serebrovaskular, gastroparesis sering terjadi.
Diagnostik
Berdasarkan data gambaran klinis, umur pasien dan riwayat CD-2, hiperglikemia berat dengan tidak adanya ketonuria dan ketoasidosis. Tanda-tanda laboratorium khas GOK disajikan dalam tabel. 7.12.
 Ara. 7 .10.
Patogenesis koma hiperosmolar
Ara. 7 .10.
Patogenesis koma hiperosmolar
Perbedaan diagnosa
Kondisi akut lain yang berkembang pada pasien dengan diabetes, paling sering dengan patologi bersamaan yang menyebabkan dekompensasi diabetes yang parah.
Pengobatan
Perawatan dan pemantauan untuk HOC, dengan pengecualian beberapa fitur, tidak berbeda dari yang dijelaskan untuk koma diabetik ketoasidosis (klausul 7.7.1):
Volume rehidrasi awal yang lebih besar 1,5-2 liter per 1 jam; 1 l - untuk jam ke-2 dan ke-3, lalu 500 ml / jam larutan natrium klorida isotonik;
Kebutuhan untuk memasukkan larutan yang mengandung kalium, sebagai suatu peraturan, lebih besar daripada dengan koma ketoasidosis;
Terapi insulin serupa dengan CC, tetapi kebutuhan insulin lebih sedikit dan kadar glikemia harus dikurangi tidak lebih cepat dari 5 mmol / L per jam untuk menghindari perkembangan edema serebral;
Penggunaan larutan hipotonik (NaCl 0,45%) sebaiknya dihindari (hanya dengan hipernatremia berat:\u003e 155 mmol / L dan / atau osmolaritas efektif\u003e 320 mOsm / L);
Pengenalan bikarbonat tidak diperlukan (hanya di unit perawatan intensif khusus untuk asidosis dengan pH< 7,1).
Ramalan cuaca
Kematian di HOC tinggi dan mencapai 15-60%. Prognosis terburuk pada pasien usia lanjut dengan patologi bersamaan yang parah, yang seringkali menjadi alasan dekompensasi diabetes dan perkembangan HOC.
7.7.3. Hipoglikemia
Hipoglikemia- penurunan kadar glukosa serum (<2,2- 2,8 ммоль/л), сопровождающее клинический синдром, характеризующийся признаками активации симпатической нервной системы и/или дисфункцией центральной нервной системы. Гипогликемия как лабораторный феномен не тождественен понятию «гипогликемическая симптоматика», поскольку лабораторные данные и клиническая картина не всегда совпадают.
Etiologi
Overdosis sediaan insulin dan analognya, serta sediaan sulfonylurea;
Asupan makanan yang tidak mencukupi dengan latar belakang terapi antihiperglikemik yang tidak berubah;
Penerimaan minuman beralkohol;
Aktivitas fisik dengan latar belakang terapi antihiperglikemik yang tidak berubah dan / atau tanpa asupan karbohidrat tambahan;
Perkembangan komplikasi lanjut diabetes mellitus (neuropati otonom dengan gastroparesis, gagal ginjal) dan sejumlah penyakit lain (insufisiensi adrenal, hipotiroidisme, gagal hati, tumor ganas) dengan terapi hipoglikemik tidak berubah (asupan berkelanjutan dan akumulasi TSP dengan latar belakang ginjal kegagalan, mempertahankan dosis insulin yang sama);
Pelanggaran teknik injeksi insulin (injeksi intramuskular bukan injeksi subkutan);
Hipoglikemia buatan (overdosis obat antihiperglikemik yang disengaja oleh pasien sendiri);
Hiperinsulinisme organik - insulinoma (lihat bagian 10.3).
Patogenesis
Patogenesis hipoglikemia adalah ketidakseimbangan antara aliran glukosa ke dalam darah, pemanfaatannya, tingkat insulin, dan hormon contrainsular. Biasanya, pada tingkat glikemik dalam kisaran 4,2-4,7 mmol / L, produksi dan pelepasan insulin dari sel β ditekan. Penurunan kadar glikemia kurang dari 3,9 mmol / l disertai dengan rangsangan produksi hormon counterinsular (glukagon, kortisol, hormon pertumbuhan, adrenalin). Gejala neuroglikopenik berkembang dengan penurunan tingkat glikemia kurang dari 2,5-2,8 mmol / l. Jika terjadi overdosis insulindan / atau obat-obatan sulfonilureahipoglikemia berkembang sebagai akibat dari efek hipoglikemik langsung dari hormon eksogen atau endogen. Dalam kasus overdosis dengan obat sulfonylurea, gejala hipoglikemik bisa berulang berkali-kali setelah kejang berhenti karena durasi kerja sejumlah obat bisa mencapai satu hari atau lebih. TSP, yang tidak memiliki efek stimulasi pada produksi insulin (metformin, thiazolidinediones), tidak dapat menyebabkan hipoglikemia sendiri, tetapi ketika ditambahkan ke sulfonylurea atau sediaan insulin, mengambil yang terakhir dalam dosis yang sama dapat menyebabkan hipoglikemia karena penumpukan antihiperglikemik. efek terapi kombinasi (Tabel 7.15).
Tab. 7.15.Hipoglikemia
 Ujung meja. 7.15
Ujung meja. 7.15
 Saat menerima alkoholterdapat penekanan glukoneogenesis di hati, yang merupakan faktor terpenting yang melawan hipoglikemia. Latihan fisikmempromosikan penggunaan glukosa yang tidak bergantung insulin, yang karenanya, dengan latar belakang terapi hipoglikemik yang tidak berubah dan / atau jika tidak ada asupan karbohidrat tambahan, dapat menyebabkan hipoglikemia.
Saat menerima alkoholterdapat penekanan glukoneogenesis di hati, yang merupakan faktor terpenting yang melawan hipoglikemia. Latihan fisikmempromosikan penggunaan glukosa yang tidak bergantung insulin, yang karenanya, dengan latar belakang terapi hipoglikemik yang tidak berubah dan / atau jika tidak ada asupan karbohidrat tambahan, dapat menyebabkan hipoglikemia.
Epidemiologi
Hipoglikemia ringan dan cepat sembuh pada pasien diabetes tipe 1 yang menerima terapi insulin intensif dapat berkembang beberapa kali seminggu dan relatif tidak berbahaya. Untuk satu pasien yang menjalani terapi insulin intensif, terdapat 1 kasus hipoglikemia berat per tahun. Dalam kebanyakan kasus, hipoglikemia terjadi pada malam hari. Dengan diabetes melitus, 20% pasien yang menerima insulin dan 6% pasien yang menerima sulfonilurea mengalami setidaknya satu episode hipoglikemia berat selama 10 tahun.
Manifestasi klinis
Ada dua kelompok gejala utama: adrenergik, terkait dengan aktivasi sistem saraf simpatis dan pelepasan adrenalin oleh kelenjar adrenal, dan neuroglikopenik, terkait dengan disfungsi sistem saraf pusat dengan latar belakang kekurangan energi utamanya. substrat. UNTUK adrenergikgejalanya meliputi: takikardia, midriasis; kecemasan, agresivitas; gemetar, keringat dingin, paresthesia; mual, kelaparan parah, hipersalivasi; diare, buang air kecil banyak. UNTUK neuroglikopenikgejala termasuk astenia,
penurunan konsentrasi, sakit kepala, ketakutan, kebingungan, disorientasi, halusinasi; bicara, penglihatan, gangguan perilaku, amnesia, gangguan kesadaran, kejang, kelumpuhan sementara, koma. Mungkin tidak ada ketergantungan yang jelas tentang tingkat keparahan dan urutan perkembangan gejala saat hipoglikemia memburuk. Hanya gejala adrenergik atau hanya neuroglikopenik yang dapat terjadi. Dalam beberapa kasus, meskipun normoglikemia telah pulih dan terapi berkelanjutan, pasien dapat tetap dalam keadaan pingsan atau bahkan koma selama beberapa jam atau bahkan berhari-hari. Hipoglikemia berkepanjangan atau episodenya yang sering dapat menyebabkan perubahan permanen pada sistem saraf pusat (terutama di korteks serebral), manifestasinya bervariasi secara signifikan dari episode mengigau dan halusinasi-paranoid hingga serangan epilepsi khas, hasil yang tak terelakkan adalah demensia persisten. .
Hiperglikemia lebih mudah ditoleransi oleh pasien daripada episode hipoglikemia ringan sekalipun. Oleh karena itu, banyak pasien, karena takut akan hipoglikemia, menganggap perlu untuk mempertahankan glikemia pada tingkat yang relatif tinggi, yang sebenarnya berhubungan dengan dekompensasi penyakit. Mengatasi stereotip ini terkadang membutuhkan banyak upaya dari dokter dan staf pengajar.
Diagnostik
Gambaran klinis hipoglikemia pada pasien diabetes yang dikombinasikan dengan deteksi laboratorium (biasanya menggunakan glukometer) kadar glukosa darah rendah.
Perbedaan diagnosa
Alasan lain yang menyebabkan hilangnya kesadaran. Jika alasan hilangnya kesadaran pasien dengan diabetes tidak diketahui dan tidak mungkin untuk melakukan analisis tingkat glikemia, ditunjukkan pengenalan glukosa. Seringkali ada kebutuhan untuk mengetahui alasan perkembangan sering hipoglikemia pada pasien diabetes. Paling sering hal itu disebabkan oleh terapi antihiperglikemik yang tidak memadai dan tingkat pengetahuan pasien yang rendah tentang penyakit mereka. Perlu diingat bahwa sejumlah penyakit (insufisiensi adrenal, hipotiroidisme, insufisiensi ginjal dan hati), termasuk tumor ganas, dapat menyebabkan penurunan kebutuhan terapi hipoglikemik hingga pembatalan totalnya ("diabetes menghilang").
Pengobatan
Untuk pengobatan hipoglikemia ringan, di mana pasien dalam keadaan sadar dan bisa menolong dirinya sendiri, biasanya cukup mengonsumsi makanan atau cairan yang mengandung karbohidrat dalam jumlah 1-2 unit roti (10-20 g glukosa). Jumlah tersebut misalnya terkandung dalam 200 ml jus buah manis. Minuman lebih efektif dalam meredakan hipoglikemia, karena glukosa lebih cepat diserap dalam bentuk cair. Jika gejala terus meningkat meskipun asupan karbohidrat dilanjutkan, glukosa intravena atau glukagon intramuskular diperlukan. Hipoglikemia berat dengan kehilangan kesadaran diperlakukan dengan cara yang sama. Dalam kasus ini, pasien disuntik sekitar 50 ml Larutan glukosa 40% secara intravena.Pengenalan glukosa harus dilanjutkan sampai serangan berhenti dan glikemia menjadi normal, meskipun dosis yang lebih besar - hingga 100 ml atau lebih, sebagai aturan, tidak diperlukan. Glukagondisuntikkan (biasanya dengan jarum suntik yang disiapkan di pabrik) secara intramuskular atau subkutan. Setelah beberapa menit, kadar glikemia dinormalisasi karena induksi glukagon glikogenolisis. Namun, hal ini tidak selalu terjadi: dengan kadar insulin yang tinggi dalam darah, glukagon tidak efektif. Waktu paruh glukagon lebih pendek dari pada insulin. Dengan alkoholisme dan penyakit hati, sintesis glikogen terganggu, dan pemberian glukagon mungkin tidak efektif. Efek samping pemberian glukagon mungkin muntah, yang menimbulkan bahaya aspirasi. Diinginkan bagi kerabat pasien untuk menguasai teknik injeksi glukagon.
Ramalan cuaca
Hipoglikemia ringan pada pasien terlatih dengan kompensasi penyakit yang baik aman. Sering hipoglikemia merupakan tanda kompensasi diabetes yang buruk; dalam kebanyakan kasus, pasien-pasien ini mengalami hiperglikemia yang kurang lebih jelas dan kadar hemoglobin terglikasi yang tinggi selama sisa hari itu. Pada pasien usia lanjut dengan komplikasi lanjut diabetes, hipoglikemia dapat memicu komplikasi vaskular seperti infark miokard, stroke, dan perdarahan retina. Koma hipoglikemik yang berlangsung hingga 30 menit dengan pengobatan yang memadai dan kesadaran kembali yang cepat, biasanya, tidak memiliki komplikasi dan konsekuensi apa pun.
7.8. KOMPLIKASI DIABETES TERLAMBAT
Komplikasi lanjut berkembang dengan kedua jenis diabetes. Secara klinis, ada lima komplikasi utama diabetes: makroangiopati, nefropati, retinopati, neuropati, dan sindrom kaki diabetik. Non-spesifisitas komplikasi lanjut untuk jenis diabetes tertentu ditentukan oleh fakta bahwa hubungan patogenetik utamanya adalah hiperglikemia kronis. Dalam hal ini, pada saat manifestasi CD-1, komplikasi lanjut pada pasien hampir tidak pernah terjadi, berkembang selama bertahun-tahun dan dekade, tergantung pada efektivitas terapi. Signifikansi klinis terbesar pada DM-1, sebagai aturan, diperoleh mikroangiopati diabetes(nefropati, retinopati) dan neuropati (sindrom kaki diabetik). Sebaliknya, pada DMT2, komplikasi lanjut sering kali sudah terdeteksi pada saat diagnosis. Pertama, ini disebabkan oleh fakta bahwa CD-2 memanifestasikan dirinya jauh sebelum diagnosis ditegakkan. Kedua, aterosklerosis, yang secara klinis dimanifestasikan oleh makroangiopati, memiliki banyak hubungan patogenetik dengan diabetes mellitus. Pada DM-2, signifikansi klinis terbesar, biasanya, didapat oleh penderita diabetes makroangiopati,yang pada saat diagnosis terdeteksi pada sebagian besar pasien. Dalam setiap kasus, set dan tingkat keparahan komplikasi lanjut individu bervariasi dari tidak adanya sama sekali paradoks, meskipun durasi penyakit yang cukup lama, hingga kombinasi dari semua opsi yang mungkin dalam bentuk yang parah.
Komplikasi terlambat adalah penyebab utama kematianpasien dengan diabetes, dan dengan mempertimbangkan prevalensinya - masalah kesehatan medis dan sosial yang paling penting di sebagian besar negara. Tentang tujuan utama pengobatandan observasi pasien diabetes adalah pencegahan (primer, sekunder, tersier) dari komplikasi lanjutnya.
7.8.1. Makroangiopati diabetes
Makroangiopati diabetes- konsep kolektif yang menyatukan lesi aterosklerotik arteri besar pada diabetes,
secara klinis dimanifestasikan oleh penyakit jantung iskemik (IHD), aterosklerosis yang melenyapkan pembuluh otak, ekstremitas bawah, organ dalam, dan hipertensi arteri (Tabel 7.16).
Tab. 7.16.Makroangiopati diabetes
 Etiologi dan patogenesis
Etiologi dan patogenesis
Mungkin mirip dengan etiologi dan patogenesis aterosklerosis pada orang tanpa diabetes. Plak aterosklerotik tidak berbeda dalam struktur mikroskopis pada individu dengan dan tanpa diabetes. Namun demikian, pada diabetes, faktor risiko tambahan mungkin muncul, atau diabetes diperburuk oleh faktor nonspesifik yang diketahui. Mereka yang menderita diabetes harus mencakup:
1. Hiperglikemia.Merupakan faktor risiko perkembangan aterosklerosis. Peningkatan kadar HbA1c sebesar 1% pada penderita diabetes melitus meningkat
risiko berkembangnya infark miokard adalah 15%. Mekanisme aksi aterogenik hiperglikemia tidak sepenuhnya jelas; ini mungkin terkait dengan glikasi produk akhir metabolisme LDL dan kolagen vaskular.
2. Hipertensi arteri(AH). Dalam patogenesis, komponen ginjal sangat penting (nefropati diabetik).AH pada DM-2 merupakan faktor risiko yang tidak kalah signifikan untuk serangan jantung dan stroke dibandingkan hiperglikemia.
3. Dislipidemia.Hiperinsulinemia, yang merupakan komponen integral dari resistensi insulin pada DMT2, menyebabkan penurunan kolesterol HDL, peningkatan trigliserida, dan penurunan densitas, mis. peningkatan aterogenisitas LDL.
4. Kegemukan,yang mempengaruhi sebagian besar pasien diabetes mellitus, merupakan faktor risiko independen untuk aterosklerosis, infark miokard, dan stroke (lihat paragraf 11.2).
5. Resistensi insulin.Hiperinsulinemia dan kadar molekul insulin-proinsulin yang tinggi meningkatkan risiko aterosklerosis, yang mungkin terkait dengan disfungsi endotel.
6. Pelanggaran pembekuan darah.Dengan diabetes, peningkatan kadar fibrinogen, aktivator inhibitor trombosit dan faktor von Willebrand ditentukan, sebagai akibatnya keadaan prothrombotik dari sistem pembekuan darah terbentuk.
7. Disfungsi endotel,ditandai dengan peningkatan ekspresi aktivator inhibitor plasminogen dan molekul adhesi sel.
8. Stres oksidatifmenyebabkan peningkatan konsentrasi LDL dan F2-isoprostan teroksidasi.
9. Peradangan sistemikdi mana terjadi peningkatan ekspresi fibrinogen dan protein C-reaktif.
Faktor risiko yang paling signifikan untuk perkembangan penyakit arteri koroner pada diabetes tipe 2 adalah peningkatan kolesterol LDL, penurunan kolesterol HDL, hipertensi, hiperglikemia, dan merokok. Salah satu perbedaan antara proses aterosklerotik pada diabetes mellitus adalah yang lebih umum dan sifat distal dari lesi oklusif,itu. Arteri yang relatif lebih kecil lebih sering terlibat dalam proses tersebut, yang mempersulit perawatan bedah dan memperburuk prognosis.
Epidemiologi
Risiko terkena penyakit arteri koroner pada penderita diabetes melitus 6 kali lebih tinggi dibandingkan pada orang tanpa diabetes, sedangkan pada pria dan wanita sama saja. Hipertensi arteri terdeteksi pada 20% pasien diabetes tipe 1 dan 75% pasien diabetes tipe 2. Secara umum, pada penderita diabetes, hal itu terjadi 2 kali lebih sering dibandingkan pada mereka yang tanpa diabetes. Aterosklerosis yang melemahkan pembuluh perifer berkembang pada 10% pasien dengan diabetes. Tromboemboli serebral berkembang pada 8% pasien diabetes (2-4 kali lebih sering dibandingkan pada orang tanpa diabetes).
Manifestasi klinis
Pada dasarnya, mereka tidak berbeda dengan orang-orang tanpa diabetes. Dalam gambaran klinis CD-2, komplikasi makrovaskuler (infark miokard, stroke, lesi oklusif pada pembuluh kaki) sering muncul, dan selama perkembangannya hiperglikemia sering kali pertama kali terdeteksi pada pasien. Mungkin karena neuropati otonom yang terjadi bersamaan, hingga 30% infark miokard pada diabetisi berlanjut tanpa serangan anginal khas (infark tanpa rasa sakit).
Diagnostik
Prinsip diagnosis komplikasi aterosklerosis (penyakit arteri koroner, kecelakaan serebrovaskular, lesi oklusif pada arteri kaki) tidak berbeda dengan orang tanpa diabetes. Pengukuran tekanan darah(BP) harus dilakukan pada setiap kunjungan pasien diabetes ke dokter, dan penentuan indikator spektrum lipiddarah (kolesterol total, trigliserida, LDL, HDL) dengan diabetes harus dilakukan setidaknya setahun sekali.
Perbedaan diagnosa
Penyakit kardiovaskular lainnya, hipertensi arteri simtomatik, dislipidemia sekunder.
Pengobatan
♦ Kontrol tekanan darah.Tingkat tekanan darah sistolik yang tepat pada penderita diabetes adalah kurang dari 130 mmHg, dan diastolik 80 mmHg (Tabel 7.3). Kebanyakan pasien membutuhkan beberapa obat antihipertensi untuk mencapai tujuan ini. Obat pilihan untuk terapi antihipertensi untuk diabetes adalah penghambat ACE dan penghambat reseptor angiotensin, yang, jika perlu, dilengkapi dengan diuretik tiazid. Obat pilihan untuk pasien diabetes yang pernah mengalami infark miokard adalah penyekat β.
♦ Koreksi dislipidemia.Level target indikator spektrum lipid disajikan dalam tabel. 7.3. Obat pilihan untuk terapi penurun lipid adalah 3-hydroxy-3-methylglutaryl-CoA reductase inhibitor (statin).
♦ Terapi antiplatelet.Terapi aspirin (75-100 mg / hari) diindikasikan untuk pasien dengan diabetes berusia di atas 40 tahun dengan peningkatan risiko pengembangan patologi kardiovaskular (riwayat keluarga yang terbebani, hipertensi arteri, merokok, dislipidemia, mikroalbuminuria), serta untuk semua pasien dengan manifestasi klinis aterosklerosis sebagai pencegahan sekunder.
♦ Skrining dan pengobatan penyakit arteri koroner.Tes latihan untuk mengecualikan penyakit jantung koroner diindikasikan pada pasien dengan gejala penyakit kardiovaskular, serta dalam deteksi patologi dengan EKG.
Ramalan cuaca
75% pasien dengan DMT2 dan 35% pasien T1DM meninggal karena penyakit kardiovaskular. Sekitar 50% pasien diabetes melitus-2 meninggal akibat komplikasi penyakit arteri koroner, 15% akibat tromboemboli serebral. Kematian akibat infark miokard pada penderita diabetes melebihi 50%.
7.8.2. Retinopati diabetik
Retinopati diabetik(DR) - mikroangiopati pembuluh retina, ditandai dengan perkembangan mikroaneurisma, perdarahan, perubahan eksudatif dan proliferasi pembuluh darah yang baru terbentuk, yang menyebabkan hilangnya penglihatan sebagian atau seluruhnya (Tabel 7.17).
Etiologi
Faktor etiologi utama dalam perkembangan DR adalah hiperglikemia kronis. Faktor lain (hipertensi arteri, dislipidemia, merokok, kehamilan, dll.) Kurang penting.
Patogenesis
Tautan utama dalam patogenesis DR adalah:
Mikroangiopati pembuluh retinal, yang menyebabkan penyempitan lumen vaskular dengan perkembangan hipoperfusi;
Degenerasi pembuluh darah dengan pembentukan mikroaneurisma;
Hipoksia progresif, merangsang proliferasi vaskular dan menyebabkan degenerasi lemak dan pengendapan garam kalsium di retina;
Tab. 7.17.Retinopati diabetik
 infark mikro dengan eksudasi, yang mengarah ke pembentukan "bintik kapas" lembut;
infark mikro dengan eksudasi, yang mengarah ke pembentukan "bintik kapas" lembut;
Deposisi lipid dengan pembentukan eksudat padat;
Pertumbuhan pembuluh darah yang berkembang biak di retina dengan pembentukan pirau dan aneurisma, menyebabkan dilatasi vena dan memperburuk hipoperfusi retina;
Fenomena mencuri dengan perkembangan iskemia lebih lanjut, yang merupakan penyebab pembentukan infiltrat dan bekas luka;
Detasemen retina akibat disintegrasi iskemiknya dan pembentukan traksi vitreoretinal;
Perdarahan vitreous akibat serangan jantung hemoragik, invasi vaskular masif dan pecahnya aneurisma;
Proliferasi pembuluh iris (rubeosis diabetik), menyebabkan perkembangan glaukoma sekunder;
Makulopati dengan edema retinal.
Epidemiologi
DR merupakan penyebab kebutaan tersering pada populasi usia kerja di negara maju, dan risiko kebutaan pada pasien diabetes 10-20 kali lebih tinggi dibandingkan pada populasi umum. Pada saat diagnosis CD-1, DR tidak terdeteksi di hampir semua pasien, setelah 5 tahun penyakit ini terdeteksi pada 8% pasien, dan dengan tiga puluh tahun diabetes - pada 98% pasien. Pada saat diagnosis CD-2, DR terdeteksi pada 20-40% pasien, dan di antara pasien dengan pengalaman lima belas tahun, CD-2 - pada 85%. Pada diabetes tipe 1, retinopati proliferatif relatif lebih umum, dan pada diabetes tipe 2, makulopati (75% kasus makulopati).
Manifestasi klinis
Menurut klasifikasi yang diterima secara umum, ada 3 tahapan DR
(Tabel 7.18).
Diagnostik
Pemeriksaan oftalmologi lengkap, termasuk oftalmoskopi langsung dengan memotret retina, diindikasikan untuk pasien dengan T1DM 3-5 tahun setelah onset penyakit, dan untuk pasien dengan DMT2 segera setelah deteksi. Ke depan, studi semacam itu harus diulang setiap tahun.
Tab. 7.18.Klasifikasi retinopati diabetik
 Perbedaan diagnosa
Perbedaan diagnosa
Penyakit mata lainnya pada penderita diabetes.
Pengobatan
Prinsip dasar pengobatan retinopati diabetik, serta komplikasi lanjut lainnya, adalah kompensasi diabetes yang optimal. Pengobatan yang paling efektif untuk retinopati diabetik dan mencegah kebutaan adalah fotokoagulasi laser.Tujuan
 Ara. 7.11.Retinopati diabetik:
Ara. 7.11.Retinopati diabetik:
a) non-proliferatif; b) praproliferatif; c) berkembang biak
fotokoagulasi laser adalah penghentian fungsi pembuluh darah yang baru terbentuk, yang menimbulkan ancaman utama bagi perkembangan komplikasi parah seperti hemophthalmus, pelepasan retinal traksi, rubeosis iris dan glaukoma sekunder.
Ramalan cuaca
Kebutaan tercatat pada 2% pasien DM (3-4% pasien DM-1 dan 1,5-2% pasien DM-2). Perkiraan kejadian kasus baru kebutaan terkait DR adalah 3,3 per 100.000 penduduk per tahun. Pada DM-1, penurunan HbA1c menjadi 7,0% menyebabkan 75% penurunan risiko pengembangan DR dan penurunan risiko perkembangan DR sebesar 60%. Pada DMT2, penurunan 1% HbA1c menyebabkan penurunan 20% risiko pengembangan DR.
7.8.3. Nefropati diabetik
Nefropati diabetik(DNP) didefinisikan sebagai albuminuria (lebih dari 300 mg albumin per hari atau proteinuria lebih dari 0,5 g protein per hari) dan / atau penurunan fungsi filtrasi ginjal pada penderita diabetes tanpa adanya infeksi saluran kemih, gagal jantung , atau penyakit ginjal lainnya. Mikroalbuminuria didefinisikan sebagai ekskresi albumin 30-300 mg / hari atau 20-200 μg / menit.
Etiologi dan patogenesis
Faktor risiko utama DNF adalah durasi diabetes mellitus, hiperglikemia kronis, hipertensi arteri, dislipidemia, dan penyakit ginjal pada orang tua. Dengan DNF, itu terutama terpengaruh alat glomerulusginjal.
1. Salah satu mekanisme yang mungkin digunakan hiperglikemiamempromosikan perkembangan kerusakan glomerulus, adalah akumulasi sorbitol karena aktivasi jalur poliol metabolisme glukosa, serta sejumlah produk akhir glikasi.
2. Gangguan hemodinamik, yaitu hipertensi arteri intraglomerular(peningkatan tekanan darah di dalam glomeruli ginjal) merupakan komponen penting dari patogenesis
Penyebab hipertensi intraglomerular adalah pelanggaran nada arteriol: perluasan aliran masuk dan penyempitan aliran keluar.
Tab. 7.19.Nefropati diabetik
 Ini, pada gilirannya, terjadi di bawah pengaruh sejumlah faktor humoral, seperti angiotensin-2 dan endotelin, serta karena pelanggaran sifat elektrolit membran basal glomeruli. Selain itu, hipertensi intraglomerular dipromosikan oleh hipertensi sistemik, yang ditentukan pada kebanyakan pasien dengan DNF. Karena hipertensi intraglomerular, terjadi kerusakan pada membran basal dan pori-pori filtrasi,
Ini, pada gilirannya, terjadi di bawah pengaruh sejumlah faktor humoral, seperti angiotensin-2 dan endotelin, serta karena pelanggaran sifat elektrolit membran basal glomeruli. Selain itu, hipertensi intraglomerular dipromosikan oleh hipertensi sistemik, yang ditentukan pada kebanyakan pasien dengan DNF. Karena hipertensi intraglomerular, terjadi kerusakan pada membran basal dan pori-pori filtrasi,
melalui jejak mana (mikroalbuminuria),dan kemudian sejumlah besar albumin (proteinuria).Penebalan membran basal menyebabkan perubahan pada sifat elektrolitnya, yang dengan sendirinya menyebabkan masuknya albumin dalam jumlah yang lebih besar ke dalam ultrafiltrasi, bahkan dengan tidak adanya perubahan ukuran pori-pori filtrasi.
3. Kecenderungan genetik.Hipertensi arteri terjadi dengan peningkatan frekuensi pada kerabat pasien dengan DNF. Ada bukti hubungan antara polimorfisme gen DNP dan ACE. Secara mikroskopis, DNF menunjukkan penebalan membran basal glomeruli, perluasan mesangium, serta perubahan fibrotik pada arteriol yang masuk dan keluar. Pada tahap akhir, yang secara klinis sesuai dengan gagal ginjal kronis (CRF), fokal (Kimmelstil-Wilson), dan kemudian glomerulosklerosis difus ditentukan.
Epidemiologi
Mikroalbuminuria terdeteksi pada 6-60% pasien DM-1 5-15 tahun setelah manifestasinya. DNF ditentukan pada 35% pasien dengan CD-1, lebih sering pada pria dan pada individu yang mengembangkan CD-1 pada usia 15 tahun. Dengan DM-2, DNF berkembang di 25% ras Eropa dan 50% ras Asia. Prevalensi keseluruhan DNP pada DM-2 adalah 4-30%.
Manifestasi klinis
Manifestasi klinis yang relatif dini, yang secara tidak langsung berhubungan dengan DNP, adalah hipertensi arteri. Manifestasi lain yang jelas secara klinis terlambat. Ini termasuk manifestasi sindrom nefrotik dan gagal ginjal kronis.
Diagnostik
Skrining untuk DNP pada penderita diabetes melibatkan pengujian tahunan untuk mikroalbuminuriadengan DM-1 5 tahun setelah onset penyakit, dan dengan DM-2 - segera setelah deteksi. Selain itu, setidaknya penentuan tahunan tingkat kreatinin diperlukan untuk menghitung laju filtrasi glomerulus (GFR).GFR dapat dihitung menggunakan berbagai rumus, seperti rumus Cockcroft-Gault:
Untuk pria: a \u003d 1,23 (norma GFR 100 - 150 ml / menit) Untuk wanita: a \u003d 1,05 (norma GFR 85 - 130 ml / menit)
Pada tahap awal DNF, peningkatan GFR dapat dideteksi, yang secara bertahap menurun seiring dengan berkembangnya gagal ginjal kronis. Mikroalbuminuria mulai ditentukan 5-15 tahun setelah onset CD-1; dengan DM-2, pada 8-10% kasus, ia terdeteksi segera setelah dideteksi, mungkin karena perjalanan penyakit asimtomatik yang lama sebelum diagnosis ditegakkan. Puncak perkembangan proteinuria atau albuminuria pada diabetes tipe 1 terjadi antara 15 dan 20 tahun setelah onsetnya. Proteinuria menunjukkan tidak dapat diubahDNF, yang cepat atau lambat akan menyebabkan gagal ginjal kronis. Uremia berkembang rata-rata 7-10 tahun setelah timbulnya proteinuria secara nyata. Perlu dicatat bahwa GFR tidak berkorelasi dengan proteinuria.
Perbedaan diagnosa
Penyebab lain dari proteinuria dan gagal ginjal pada penderita diabetes. Dalam kebanyakan kasus, DNF dikombinasikan dengan hipertensi arteri, retinopati diabetik atau neuropati, jika tidak ada diagnosis banding harus sangat hati-hati. Dalam 10% kasus dengan CD-1 dan dalam 30% kasus dengan CD-2, proteinuria tidak terkait dengan DNP.
Pengobatan
♦ Kondisi utama primer dan sekunder pencegahan
DNFkompensasi untuk diabetes dan pemeliharaan tekanan darah sistemik normal. Selain itu, pencegahan utama DNP menyiratkan penurunan asupan protein - kurang dari 35% dari asupan kalori harian.
♦ Secara bertahap mikroalbuminuriadan proteinuriapasien ditunjukkan pengangkatan inhibitor ACE atau penghambat reseptor angiotensin. Dengan hipertensi arteri bersamaan, mereka diresepkan dalam dosis antihipertensi, jika perlu dikombinasikan dengan obat antihipertensi lainnya. Pada tekanan darah normal, obat ini diresepkan dalam dosis yang tidak mengarah pada perkembangan hipotensi. Inhibitor ACE (dengan CD-1 dan CD-2) dan penghambat reseptor angiotensin (dengan CD-2) membantu mencegah transisi mikroalbuminuria menjadi proteinuria. Dalam beberapa kasus, dengan latar belakang terapi ini dalam kombinasi dengan kompensasi diabetes untuk parameter lain, mikroalbuminuria dihilangkan. Selain itu, perlu dimulai dari tahap mikroalbuminuria
mengurangi asupan protein hingga kurang dari 10% dari asupan kalori harian (atau kurang dari 0,8 gram per kg berat badan) dan garam menjadi kurang dari 3 gram per hari.
♦ Di atas panggung Gagal ginjal kronis,sebagai aturan, diperlukan koreksi terapi antihiperglikemik. Kebanyakan pasien dengan diabetes mellitus 2 perlu dipindahkan ke terapi insulin, karena akumulasi TSP membawa risiko berkembangnya hipoglikemia yang parah. Pada kebanyakan pasien diabetes melitus, terdapat penurunan kebutuhan insulin, karena ginjal merupakan salah satu tempat utama metabolisme. Dengan peningkatan kadar kreatinin serum hingga 500 μmol / L atau lebih, perlu diajukan pertanyaan tentang persiapan pasien untuk metode pengobatan ekstrakorporeal (hemodialisis, dialisis peritoneal) atau bedah (transplantasi ginjal). Transplantasi ginjal diindikasikan pada tingkat kreatinin hingga 600-700 μmol / L dan penurunan laju filtrasi glomerulus kurang dari 25 ml / menit, hemodialisis - 1000-1200 μmol / L dan kurang dari 10 ml / menit, masing-masing.
Ramalan cuaca
Pada 50% pasien diabetes tipe 1 dan 10% pasien diabetes tipe 2, yang proteinuria-nya terdeteksi, gagal ginjal kronis berkembang selama 10 tahun ke depan. 15% dari semua kematian pasien diabetes tipe 1 di bawah usia 50 tahun berhubungan dengan gagal ginjal kronis karena DNF.
7.8.4. Neuropati diabetes
Neuropati diabetes(DNE) adalah kombinasi sindrom lesi pada sistem saraf, yang dapat diklasifikasikan tergantung pada keterlibatan utama dalam proses berbagai departemen (sensorimotor, otonom), serta prevalensi dan keparahan lesi (Tabel 7.20) ).
SAYA. Neuropati sensomotor:
Simetris;
Fokal (mononeuropati) atau polifokal (kranial, motorik proksimal, mononeuropati tungkai dan badan).
II. Neuropati otonom (otonom):
Kardiovaskular (hipotensi ortostatik, sindrom denervasi jantung);
Gastrointestinal (atonia lambung, diskinesia bilier, enteropati diabetik);
Urogenital (dengan disfungsi kandung kemih dan fungsi seksual);
Kemampuan pasien yang terganggu untuk mengenali hipoglikemia;
Disfungsi pupil;
Disfungsi kelenjar keringat (anhidrosis distal, hiperhidrosis dengan makanan).
Tab. 7.20.Neuropati diabetes
 Etiologi dan patogenesis
Etiologi dan patogenesis
Penyebab utama DNE adalah hiperglikemia. Beberapa mekanisme patogenesisnya disarankan:
Aktivasi jalur poliol metabolisme glukosa, akibatnya akumulasi sorbitol, fruktosa dan penurunan kandungan myo-inositol dan glutathione terjadi di sel saraf. Ini, pada gilirannya, mengarah pada aktivasi proses radikal bebas dan penurunan tingkat oksida nitrat;
Glikosilasi non-enzimatik membran dan protein sitoplasma sel saraf;
Mikroangiopati vasa nervorum,yang menyebabkan perlambatan aliran darah kapiler dan hipoksia saraf.
Epidemiologi
Prevalensi DNE pada kedua jenis diabetes ini sekitar 30%. Dengan DM-1, setelah 5 tahun sejak timbulnya penyakit, penyakit ini mulai terdeteksi pada 10% pasien. Insiden kasus baru DNE pada DM-2 adalah sekitar 6% pasien per tahun. Varian yang paling umum adalah DNE sensorimotor simetris distal.
Manifestasi klinis
Sensorimotor DNEmemanifestasikan dirinya dalam kompleks gangguan motorik dan sensorik. Gejala umum dari bentuk distal DNE adalah paresthesia,yang dimanifestasikan dengan perasaan "merayap", mati rasa. Penderita sering mengeluh kaki terasa dingin, meski tetap hangat saat disentuh, yang merupakan tanda yang membedakan polineuropati dari perubahan iskemik saat kaki terasa dingin saat disentuh. Manifestasi awal neuropati sensorik adalah pelanggaran sensitivitas getaran. Sindrom kaki gelisah, yang merupakan kombinasi dari paresthesia nokturnal dan hipersensitivitas, merupakan karakteristiknya. Sakit kakilebih sering terganggu pada malam hari, sementara terkadang pasien tidak tahan dengan sentuhan selimut. Biasanya, nyeri, sebagai lawan dari penyakit arteri yang melenyap, dapat diatasi dengan berjalan. Selama bertahun-tahun, nyeri dapat berhenti secara spontan karena kematian serabut saraf kecil yang bertanggung jawab atas sensitivitas nyeri. Hypoesthesiadimanifestasikan oleh hilangnya kepekaan seperti "stoking" dan "sarung tangan". Gangguan sensitivitas proprioseptif yang dalam menyebabkan gangguan koordinasi dan kesulitan dalam bergerak (ataksia sensorik). Pasien mengeluh tentang "kaki orang lain", perasaan "berdiri di atas kapas". Pelanggaran persarafan trofik menyebabkan perubahan degeneratif pada kulit, tulang dan tendon. Pelanggaran sensitivitas nyeri menyebabkan sering, tanpa disadari oleh pasien, mikrotrauma kaki, yang mudah terinfeksi. Koordinasi yang terganggu dan berjalan menyebabkan redistribusi beban non-fisiologis pada persendian kaki. Akibatnya, hubungan anatomis pada sistem muskuloskeletal kaki terganggu.
Lengkungan kaki berubah bentuk, edema, patah tulang, dan proses purulen kronis berkembang (lihat klausul 7.8.5).
Ada beberapa bentuk hari otonom. Sebab bentuk kardiovaskular- pelanggaran persarafan kompleks kardiopulmoner dan pembuluh besar. Saraf vagus adalah saraf terpanjang, dan karena itu terpengaruh lebih awal dari yang lain. Sebagai hasil dari dominasi pengaruh simpatik, istirahat takikardia.Respon yang tidak memadai terhadap ortostasis terwujud hipotensi ortostatikdan sinkop. Denervasi vegetatif kompleks jantung paru menyebabkan tidak adanya variabilitas detak jantung. Peningkatan prevalensi infark miokard tanpa rasa sakit di antara pasien diabetes dikaitkan dengan neuropati otonom.
Gejala bentuk gastrointestinalDAYS adalah gastroparesis dengan penundaan atau, sebaliknya, pengosongan lambung yang cepat, yang dapat menimbulkan kesulitan dalam pemilihan terapi insulin, karena waktu dan volume penyerapan karbohidrat bervariasi tanpa batas; atonia esofagus, refluks esofagitis, disfagia; diare berair. Untuk bentuk urogenitalDAY ditandai dengan atonia ureter dan kandung kemih, yang mengarah ke kecenderungan infeksi saluran kemih; disfungsi ereksi (sekitar 50% pasien diabetes); ejakulasi retrograde.
Manifestasi lain yang mungkin dari DNE otonom adalah gangguan kemampuan mengenali hipoglikemia, gangguan fungsi pupil, gangguan fungsi kelenjar keringat (anhidrosis), amiotrofi diabetik.
Diagnostik
Pemeriksaan neurologis pasien diabetes harus dilakukan setiap tahun. Minimal, ini melibatkan pengujian neuropati sensorimotor distal. Untuk ini, penilaian sensitivitas getaran menggunakan garpu tala bertingkat, sensitivitas taktil menggunakan monofilamen, serta sensitivitas suhu dan nyeri digunakan. Menurut indikasinya, keadaan sistem saraf otonom dipelajari: untuk mendiagnosis ketidakcukupan persarafan parasimpatis jantung, sejumlah tes fungsional digunakan, seperti mengukur detak jantung selama pernapasan dalam dengan penilaian variabilitas
detak jantung dan tes Valsava; untuk mendiagnosis ketidakcukupan persarafan simpatis jantung, tes ortostatik digunakan.
Perbedaan diagnosa
Neuropati dari genesis lain (alkoholik, uremik, dengan anemia defisiensi B 12, dll.). Diagnosis disfungsi organ akibat neuropati otonom ditegakkan hanya setelah pengecualian patologi organ.
Pengobatan
1. Optimalisasi terapi antihiperglikemik.
2. Perawatan kaki (lihat klausul 7.8.5).
3. Efektivitas obat neurotropik (asam α-lipoat) tidak dikonfirmasi di semua penelitian.
4. Terapi simtomatik (pereda nyeri, sildenafil untuk disfungsi ereksi, fludrokortison untuk hipotensi ortostatik, dll.).
Ramalan cuaca
Pada tahap awal, DNE dapat diubah dengan latar belakang kompensasi DM yang terus-menerus. DNE ditentukan pada 80% pasien dengan lesi ulseratif dan merupakan faktor risiko utama untuk amputasi kaki
7.8.5. Sindrom kaki diabetes
Sindrom kaki diabetes(SDS) adalah suatu kondisi patologis kaki pada diabetes yang terjadi dengan latar belakang kerusakan saraf tepi, kulit dan jaringan lunak, tulang dan sendi dan bermanifestasi dalam ulkus akut dan kronis, lesi osteoartikuler dan proses nekrotik purulen (Tabel 7.21) .
Etiologi dan patogenesis
Patogenesis SDS bersifat multikomponen dan diwakili oleh kombinasi gangguan neuropatik dan perfusi dengan kecenderungan infeksi yang nyata. Berdasarkan dominasi patogenesis salah satu faktor yang terdaftar, ada 3 bentuk utama
Tab. 7.21.Sindrom kaki diabetes
 I. Bentuk neuropatik(60-70 %):
I. Bentuk neuropatik(60-70 %):
Tidak ada osteoartropati;
Dengan osteoartropati diabetes.
II. Bentuk neuroiskemik (campuran)(15-20 %).
AKU AKU AKU. Bentuk iskemik(3-7 %).
Bentuk neuropatik SDS. Pada neuropati diabetes, bagian distal saraf terpanjang yang paling terpengaruh. Defisiensi impuls trofik yang berkepanjangan menyebabkan hipotrofi pada kulit, tulang, ligamen, tendon, dan otot. Hasil hipotrofi struktur ikat adalah deformitas kaki dengan redistribusi beban pendukung yang tidak fisiologis dan peningkatannya yang berlebihan di area tertentu. Di tempat-tempat ini, misalnya, di area proyeksi kepala metatarsal, penebalan kulit dan pembentukan hiperkeratosis dicatat. Tekanan konstan pada area ini menyebabkan autolisis inflamasi pada jaringan lunak di bawahnya, yang menciptakan prasyarat untuk pembentukan ulkus. Akibat atrofi dan gangguan keringat, kulit menjadi kering dan mudah pecah-pecah. Karena penurunan sensitivitas nyeri, pasien seringkali tidak memperhatikan perubahan yang terjadi. Dia tidak dapat mendeteksi ketidaknyamanan sepatu secara tepat waktu, yang menyebabkan pembentukan lecet dan kapalan, tidak memperhatikan masuknya benda asing, luka kecil di tempat-tempat retak. Situasinya diperparah oleh pelanggaran sensitivitas yang dalam, dimanifestasikan dalam pelanggaran gaya berjalan, pemasangan kaki yang tidak tepat. Cacat ulseratif yang paling umum terinfeksi stafilokokus, streptokokus, bakteri pada kelompok usus; seringkali flora anaerob bergabung. Osteoartropati neuropatik adalah hasil dari perubahan distrofik yang diucapkan pada aparatus osteoartikuler kaki (osteoporosis, osteolisis, hiperostosis).
Bentuk iskemik SDS adalah konsekuensi dari aterosklerosis arteri ekstremitas bawah, yang menyebabkan pelanggaran aliran darah utama, mis. adalah salah satu varian dari makroangiopati diabetik.
Epidemiologi
SDS diamati pada 10-25%, dan menurut beberapa data, dalam satu bentuk atau lainnya pada 30-80% pasien diabetes. Di Amerika Serikat, biaya tahunan untuk merawat pasien diabetes dan DFS adalah $ 1 miliar.
Manifestasi klinis
Kapan bentuk neuropatikSDS membedakan dua jenis lesi yang paling umum: ulkus neuropatik dan osteoartropati (dengan perkembangan
 Ara. 7.12.Ulkus neuropatik pada sindrom kaki diabetik
Ara. 7.12.Ulkus neuropatik pada sindrom kaki diabetik
 Ara. 7.13.Sendi Charcot pada sindrom kaki diabetik
Ara. 7.13.Sendi Charcot pada sindrom kaki diabetik
gabungan Charcot). Ulkus neuropatiksebagai aturan, mereka dilokalkan di wilayah ruang tunggal dan interdigital, mis. di area kaki yang mengalami tekanan terbesar (Gbr. 7.12).
Perubahan merusak pada alat osteo-ligamen kaki dapat berkembang selama berbulan-bulan dan menyebabkan deformitas tulang yang parah - osteo-artropati diabetesdan formasi sendi Charcotsedangkan kaki secara kiasan dibandingkan dengan "sekantong tulang"
Kapan bentuk iskemik SDS
kulit di kaki terasa dingin, pucat, atau sianotik; lebih jarang warnanya merah muda-merah karena perluasan kapiler superfisial sebagai respons terhadap iskemia. Cacat ulseratif terjadi sebagai nekrosis akral - di ujung jari, permukaan tepi tumit (Gbr. 7.14).
Denyut nadi di arteri kaki, arteri poplitea dan femoralis melemah atau tidak teraba.
Biasanya, pasien datang dengan klaudikasio intermiten. Tingkat keparahan lesi ekstremitas iskemik ditentukan oleh tiga faktor utama: tingkat keparahan stenosis, perkembangan aliran darah kolateral, dan keadaan sistem pembekuan darah.
Diagnostik
Pemeriksaan kaki penderita diabetes sebaiknya dilakukan setiap kali saat berkunjung ke dokter, minimal enam bulan sekali. Diagnosis SDS meliputi:
 Ara. 7.14.Nekrosis akral dalam bentuk iskemik sindrom kaki diabetik
Ara. 7.14.Nekrosis akral dalam bentuk iskemik sindrom kaki diabetik
Pemeriksaan kaki;
Penilaian status neurologis - berbagai jenis sensitivitas, refleks tendon, elektromiografi;
Penilaian keadaan aliran darah arteri - angiografi, dopplerometri, dopplerografi;
Rontgen kaki dan sendi pergelangan kaki;
Pemeriksaan bakteriologis dari pelepasan luka.
Perbedaan diagnosa
Ini dilakukan dengan proses luka pada kaki dari genesis yang berbeda, serta penyakit oklusif lainnya pada pembuluh ekstremitas bawah dan patologi sendi kaki. Selain itu, perlu dibedakan bentuk klinis DFS (Tabel 7.22).
Pengobatan
Pengobatan terinfeksi neuropatikbentuk SDS mencakup serangkaian tindakan berikut:
Optimalisasi kompensasi diabetes, sebagai aturan, peningkatan dosis insulin, dan dalam kasus diabetes mellitus-2 - transfer ke sana;
Terapi antibiotik sistemik;
Pembongkaran total kaki (ini dapat menyebabkan penyembuhan bisul yang telah ada selama bertahun-tahun);
Perawatan luka lokal dengan pengangkatan area hiperkeratosis;
Perawatan kaki, pemilihan yang tepat dan pemakaian alas kaki khusus. Memungkinkan terapi konservatif tepat waktu
hindari operasi pada 95% kasus.
Tab. 7.22.Diagnosis banding bentuk klinis SDS
 Pengobatan iskemikformulir VTS meliputi:
Pengobatan iskemikformulir VTS meliputi:
Optimalisasi kompensasi diabetes, sebagai aturan, peningkatan dosis insulin, dan dalam kasus diabetes mellitus-2 - transfer ke sana;
Dengan tidak adanya lesi ulseratif nekrotik, ergoterapi (1-2 jam berjalan sehari, berkontribusi pada perkembangan aliran darah kolateral);
Operasi revaskularisasi pada pembuluh darah yang terkena;
Terapi konservatif: antikoagulan, aspirin (sampai 100 mg / hari), jika perlu, fibrinolitik, prostaglandin E1 dan sediaan prostasiklin.
Dengan perkembangan lesi purulen-nekrotik yang luas di semua varian SDS, pertanyaan tentang amputasi dimunculkan.
Ramalan cuaca
Dari 50 sampai 70% dari total jumlah amputasi kaki yang dilakukan adalah diantara pasien diabetes melitus. Amputasi kaki pada pasien diabetes adalah 20 sampai 40 kali lebih sering dibandingkan pada pasien non-diabetes.
7.9. DIABETES DAN KEHAMILAN
Diabetes mellitus gestasional(GDM) adalah pelanggaran toleransi glukosa, pertama kali diidentifikasi selama kehamilan (Tabel 7.23). Definisi ini tidak mengesampingkan kemungkinan bahwa patologi metabolisme karbohidrat bisa mendahului permulaan kehamilan. GDM harus dibedakan dari situasi ketika seorang wanita dengan diabetes yang didiagnosis sebelumnya (karena usia, lebih sering CD-1) menjadi hamil.
Etiologi dan patogenesis
Dengan GDM, mereka mirip dengan SD-2. Kadar steroid ovarium dan plasenta yang tinggi, serta peningkatan pembentukan kortisol oleh korteks adrenal, menyebabkan perkembangan resistensi insulin fisiologis selama kehamilan. Perkembangan GDM dikaitkan dengan fakta bahwa resistensi insulin, yang secara alami berkembang selama kehamilan, dan, oleh karena itu, peningkatan kebutuhan insulin pada individu yang memiliki kecenderungan melebihi kapasitas fungsional sel β pankreas. Setelah melahirkan, dengan kembalinya hubungan hormonal dan metabolisme ke tingkat semula, biasanya akan hilang.
Tab. 7.23.Diabetes mellitus gestasional
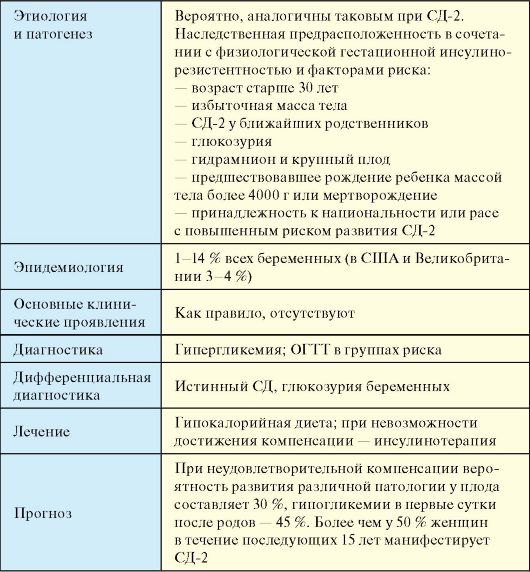 GDM biasanya berkembang di pertengahan trimester ke-2, antara 4 dan 8 bulan kehamilan. Sebagian besar pasien memiliki berat badan berlebih dan riwayat SD-2. Faktor risiko untuk perkembangan GDM, serta kelompok wanita dengan risiko rendah untuk mengembangkan GDM diberikan pada Tabel. 7.24.
GDM biasanya berkembang di pertengahan trimester ke-2, antara 4 dan 8 bulan kehamilan. Sebagian besar pasien memiliki berat badan berlebih dan riwayat SD-2. Faktor risiko untuk perkembangan GDM, serta kelompok wanita dengan risiko rendah untuk mengembangkan GDM diberikan pada Tabel. 7.24.
Tab. 7.24.Faktor risiko untuk mengembangkan diabetes gestasional
 Hiperglikemia ibu menyebabkan hiperglikemia dalam sistem peredaran darah bayi. Glukosa dengan mudah melewati plasenta dan terus mengalir ke janin dari darah ibu. Ada juga transpor aktif asam amino dan transfer badan keton ke janin. Sebaliknya, insulin, glukagon, dan asam lemak bebas dari ibu tidak masuk ke aliran darah janin. Dalam 9-12 minggu pertama kehamilan, pankreas janin belum menghasilkan insulin sendiri. Waktu ini sesuai dengan fase organogenesis janin, ketika, dengan hiperglikemia konstan, berbagai malformasi (jantung, tulang belakang, sumsum tulang belakang, saluran pencernaan) dapat terbentuk pada ibu. Sejak minggu ke-12 kehamilan, pankreas janin mulai mensintesis insulin, dan sebagai respons terhadap hiperglikemia, hipertrofi reaktif dan hiperplasia sel β pankreas janin berkembang. Karena hiperinsulinemia, makrosomia janin berkembang, serta penghambatan sintesis lesitin, yang menjelaskan tingginya insiden sindrom gangguan pernapasan pada bayi baru lahir. Akibat hiperplasia sel β dan hiperinsulinemia, terdapat kecenderungan hipoglikemia yang parah dan berkepanjangan.
Hiperglikemia ibu menyebabkan hiperglikemia dalam sistem peredaran darah bayi. Glukosa dengan mudah melewati plasenta dan terus mengalir ke janin dari darah ibu. Ada juga transpor aktif asam amino dan transfer badan keton ke janin. Sebaliknya, insulin, glukagon, dan asam lemak bebas dari ibu tidak masuk ke aliran darah janin. Dalam 9-12 minggu pertama kehamilan, pankreas janin belum menghasilkan insulin sendiri. Waktu ini sesuai dengan fase organogenesis janin, ketika, dengan hiperglikemia konstan, berbagai malformasi (jantung, tulang belakang, sumsum tulang belakang, saluran pencernaan) dapat terbentuk pada ibu. Sejak minggu ke-12 kehamilan, pankreas janin mulai mensintesis insulin, dan sebagai respons terhadap hiperglikemia, hipertrofi reaktif dan hiperplasia sel β pankreas janin berkembang. Karena hiperinsulinemia, makrosomia janin berkembang, serta penghambatan sintesis lesitin, yang menjelaskan tingginya insiden sindrom gangguan pernapasan pada bayi baru lahir. Akibat hiperplasia sel β dan hiperinsulinemia, terdapat kecenderungan hipoglikemia yang parah dan berkepanjangan.
Epidemiologi
Diabetes melitus mempengaruhi 0,3% dari semua wanita usia reproduksi, 0,2-0,3% wanita hamil pada awalnya sudah sakit diabetes, dan pada 1-14% kehamilan, GDM mengembangkan atau memanifestasikan diabetes yang sebenarnya. Prevalensi GDM bervariasi pada populasi yang berbeda, misalnya di Amerika Serikat, terdeteksi pada sekitar 4% wanita hamil (135 ribu kasus per tahun).
Manifestasi klinis
Dengan tidak adanya GDM. Mungkin ada gejala dekompensasi DM yang tidak spesifik.
Diagnostik
Penentuan glukosa darah puasa diindikasikan untuk semua wanita hamil sebagai bagian dari tes darah biokimia. Wanita yang berisiko (Tabel 7.24) ditampilkan untuk melaksanakan tes toleransi glukosa oral(OGTT). Banyak opsi untuk penerapannya pada wanita hamil telah dijelaskan. Yang paling sederhana dari mereka menyiratkan aturan berikut:
3 hari sebelum pemeriksaan, wanita tersebut melakukan diet teratur dan mengikuti aktivitas fisiknya yang biasa;
Ujian dilakukan pada pagi hari dengan perut kosong, setelah puasa semalaman minimal 8 jam;
Setelah mengambil sampel darah puasa, wanita tersebut meminum larutan 75 gram glukosa kering yang dilarutkan dalam 250-300 ml air selama 5 menit; penentuan ulang tingkat glikemia dilakukan setelah 2 jam.
Diagnosis GDM ditegakkan sebagai berikut kriteria:
Glukosa darah lengkap puasa (vena, kapiler)\u003e 6,1 mmol / L atau
Glukosa plasma darah vena ≥ 7 mmol / L atau
Glukosa dari whole blood kapiler atau plasma darah vena 2 jam setelah memuat 75 g glukosa ≥ 7,8 mmol / L.
Jika seorang wanita termasuk dalam kelompok risiko, hasil penelitiannya normal, tes diulangi pada kehamilan 24-28 minggu.
Perbedaan diagnosa
GDM dan SD sejati; glukosuria wanita hamil.
Pengobatan
Resiko bagi ibu dan janin, serta pendekatan untuk pengobatan diabetes dan kekhasan pengendaliannya pada GDM dan diabetes sejati, adalah sama. Komplikasi lanjut diabetes selama kehamilan dapat berkembang secara signifikan, namun dengan kompensasi berkualitas untuk diabetes, tidak ada indikasi penghentian kehamilan. Seorang wanita dengan diabetes (biasanya, kita berbicara tentang diabetes tipe 1) harus merencanakan kehamilan di usia muda, ketika risiko komplikasi paling rendah. Jika kehamilan direncanakan, maka dianjurkan untuk membatalkan kontra-
penerimaan setelah beberapa bulan setelah mencapai kompensasi optimal. Kontraindikasi perencanaan kehamilan adalah nefropati berat dengan gagal ginjal progresif, penyakit arteri koroner berat, retinopati proliferatif parah yang tidak dapat dikoreksi, ketoasidosis pada awal kehamilan (badan keton merupakan faktor teratogenik).
Tujuan pengobatanGDM dan diabetes sejati selama kehamilan adalah pencapaian parameter laboratorium berikut:
Glikemia puasa< 5-5,8 ммоль/л;
Glikemia 1 jam setelah makan< 7,8 ммоль/л;
Glikemia 2 jam setelah makan< 6,7 ммоль/л;
Profil Glikemik Harian Rata-rata< 5,5 ммоль/л;
Kadar HbA1c pada pemantauan bulanan sama dengan subjek sehat (4-6%).
Dengan diabetes melitus, dan juga di luar kehamilan, seorang wanita harus menerima terapi insulin intensif, namun, tingkat glikemia selama kehamilan dianjurkan untuk dinilai 7-8 kali sehari. Jika tidak mungkin mencapai kompensasi normoglikemik dengan latar belakang suntikan konvensional, perlu dipertimbangkan untuk memindahkan pasien ke terapi insulin menggunakan pompa insulin.
Pada tahap pertama pengobatan GDMterapi diet ditentukan, yang terdiri dari pembatasan asupan kalori harian hingga sekitar 25 kkal / kg berat sebenarnya, terutama karena karbohidrat dan lemak hewani yang mudah dicerna, serta peningkatan aktivitas fisik. Jika, dengan latar belakang terapi diet, tidak mungkin mencapai tujuan pengobatan, pasien harus diberi terapi insulin intensif. Semua obat antihiperglikemik tablet (TSP) selama kehamilan kontraindikasi.Ternyata diperlukan untuk mentransfer sekitar 15% wanita ke terapi insulin.
Ramalan cuaca
Dalam kasus kompensasi GDM dan DM yang tidak memuaskan selama kehamilan, kemungkinan berkembangnya berbagai patologi pada janin adalah 30% (risikonya 12 kali lebih tinggi daripada pada populasi umum). Lebih dari 50% wanita yang didiagnosis dengan GDM selama kehamilan, selama 15 tahun berikutnya, mengalami SD-2.
Dalam pencegahan penyakit multifaktorial dengan kecenderungan turun-temurun, termasuk IDDM, kaitan yang diperlukan adalahkonseling genetik medis. Tugas utama konseling medis dan genetik adalah menentukan risiko genetik dari penyakit dan menjelaskan maknanya dalam bentuk yang dapat diakses. Dengan diabetes, pasangan paling sering beralih ke konseling genetik medis untuk menilai risiko penyakit pada anak-anak di masa depan karena adanya penyakit ini pada anak-anak sebelumnya, atau dari pasangan itu sendiri dan / atau kerabat mereka.Studi genetik populasi memungkinkan untuk menghitung itu kontribusi faktor genetik terhadap perkembangan diabetes denganmenempatkan 60-80%. Dalam hal ini, konseling medis dan genetik dari kerabat pasien diabetes memiliki relevansi dan perspektif yang luar biasa.
Pertanyaan utama yang biasanya dihadapi dokter adalah risiko terkena diabetes. memiliki anak atau saudara kandungsakit, kemampuan untuk mengklasifikasikannya, dan ramalan terkaitanggota keluarga masa depan (yang direncanakan).
Konseling keluarga untuk penderita diabetes tipe 1 terdiri dari beberapa tahapan yang diterima secara umum, yang memiliki karakteristik tersendiri untuk kontingen ini.
11.1. Tahapan konseling
Tahap pertama konseling - klarifikasi diagnosis penyakit.
Biasanya, diagnosis diabetes tipe 1 pada masa kanak-kanak dan remaja tidaklah sulit. Namun, jika terdapat diabetes pada anggota keluarga lain, verifikasi jenis diabetes mereka diperlukan, yang dalam beberapa kasus dapat menjadi tugas yang sulit dan memerlukan dokter untuk mencatat riwayat keluarga yang sakit secara menyeluruh. Diagnosis banding antara dua jenis utama diabetes (1 dan 2) dilakukan sesuai dengan kriteria yang diterima secara umum.
Heterogenitas genetik dari dua tipe utama diabetes, yang dibuktikan dalam studi genetik populasi, menunjukkan kemandirian nosologis dan kemandirian pewarisan. Ini berarti bahwa kasus diabetes tipe 2 dalam silsilah pasien individu bersifat acak dan tidak boleh diperhitungkan saat menilai risiko keluarga.
Saat melakukan konseling genetik medis, perlu juga untuk mengecualikan sindrom genetik, termasuk diabetes mellitus, karena ditandai dengan pewarisan monogenik.
Konseling tahap kedua - penentuan risiko penyakit dalam kaitannya dengan anggota keluarga yang ada dan keturunan yang direncanakan.
Estimasi empiris dari risiko pengembangan diabetes untuk anggota keluarga yang memiliki kerabat dengan diabetes tipe 1 diperoleh. Kerabat tingkat kekerabatan 1 (anak-anak, orang tua, saudara laki-laki) memiliki risiko maksimum - rata-rata dari 2,5-3% hingga 5-6%. Ditemukan bahwa kejadian diabetes pada anak-anak dari ayah dengan diabetes tipe 1 1-2% lebih tinggidibandingkan dari ibu dengan diabetes tipe 1.
Dalam setiap keluarga tertentu, risiko terkena penyakit ini bergantung pada banyak faktor: jumlah kerabat yang sakit dan sehat, usia timbulnya diabetes pada anggota keluarga, usia yang diajak berkonsultasi, dll.
Tabel 8
Risiko empiris untuk kerabat pasien diabetes tipe 1
Menurut metodologi khusus, file tabel risiko pengembanganSD 1 jenisnya tergantung pada jumlah kerabat yang sakit dan sehat serta usia yang dikonsultasikan untuk keluarga dari berbagai jenis... Jenis keluarga, status orang tua dan jumlah saudara kandung yang sakit disajikan pada Tabel 9.
Sindrom Down bukanlah penyakit, ini adalah patologi yang tidak dapat dicegah dan disembuhkan. Janin dengan sindrom Down pada pasangan kromosom ke-21 memiliki kromosom tambahan ketiga, akibatnya jumlahnya bukan 46, tetapi 47. Sindrom Down diamati pada satu dari 600-1000 bayi baru lahir dari wanita berusia di atas 35 tahun. alasan mengapa ini terjadi, tidak sepenuhnya dipahami. Seorang dokter dari Inggris, John Langdon Down, adalah orang pertama yang menggambarkan sindrom ini pada tahun 1866, dan pada tahun 1959, profesor Prancis Lejeune membuktikan bahwa itu disebabkan oleh perubahan genetik.
Diketahui bahwa anak-anak menerima setengah dari kromosom mereka dari ibu dan setengah dari ayah mereka. Karena tidak ada satu pengobatan yang efektif untuk sindrom Down, penyakit ini dianggap tidak dapat disembuhkan, Anda dapat mengambil tindakan dan, jika Anda ingin melahirkan anak yang sehat, hubungi konsultasi genetik medis, di mana, berdasarkan analisis kromosom dari Orang tua, akan ditentukan apakah anak akan lahir sehat atau dengan sindrom Down.
Belakangan ini, anak-anak seperti itu lebih sering dilahirkan, mereka mengaitkannya dengan pernikahan yang terlambat, dengan merencanakan kehamilan di usia 40 tahun. Dipercaya juga bahwa jika seorang nenek melahirkan putrinya setelah usia 35, maka cucu-cucunya dapat terlahir dengan sindrom Down. Meskipun diagnosis prenatal merupakan proses pemeriksaan yang kompleks, sangat penting untuk dapat mengakhiri kehamilan.
Apa itu sindrom Down. Biasanya bisa disertai dengan keterlambatan perkembangan motorik. Anak-anak seperti itu memiliki kelainan jantung bawaan, patologi perkembangan organ saluran pencernaan. 8% pasien dengan sindrom Down menderita leukemia. Obat dapat merangsang aktivitas mental, menormalkan ketidakseimbangan hormon. Dengan bantuan prosedur fisioterapi, pijat, latihan terapeutik, Anda dapat membantu anak Anda memperoleh keterampilan yang diperlukan untuk perawatan diri. Sindrom Down dikaitkan dengan kelainan genetik, tetapi ini tidak selalu menyebabkan pelanggaran terhadap perkembangan fisik dan mental anak. Anak-anak seperti itu, dan di masa depan, orang dewasa, dapat berpartisipasi dalam semua bidang kehidupan, beberapa di antaranya menjadi aktor, atlet, dan dapat terlibat dalam urusan publik. Bagaimana seseorang dengan diagnosis ini akan berkembang sangat bergantung pada lingkungan tempat dia tumbuh. Kondisi yang baik, cinta dan perhatian berkontribusi pada perkembangan penuh.
Tabel risiko sindrom Down, berdasarkan usia
Kemungkinan sindrom Down tergantung pada usia ibu, tetapi dapat dideteksi dengan tes genetik di awal kehamilan, dan dalam beberapa kasus dengan USG. Kemungkinan bayi mengalami sindrom Down saat lahir lebih rendah dibandingkan pada tahap awal kehamilan. beberapa janin dengan sindrom Down tidak dapat bertahan hidup.

Risiko mana yang dianggap rendah dan mana yang tinggi?
Di Israel, risiko sindrom Down dianggap tinggi jika lebih tinggi dari 1: 380 (0,26%). Siapa pun yang termasuk dalam kelompok risiko ini perlu menjalani tes cairan ketuban. Risiko ini setara dengan risiko pada wanita yang hamil pada usia 35 tahun ke atas.
Risiko yang lebih rendah dari 1: 380 dianggap rendah.
Tetapi harus diingat bahwa batas-batas ini bisa mengambang! Jadi, misalnya, di Inggris, risiko tingkat tinggi dianggap risiko di atas 1: 200 (0,5%). Hal ini disebabkan fakta bahwa beberapa wanita menganggap risiko 1 dari 1000 tinggi, dan yang lain 1 dari 100 sebagai risiko rendah, karena dengan risiko seperti itu mereka memiliki 99% kemungkinan memiliki anak yang sehat.
Faktor risiko untuk sindrom Down, Edwards, Patau
Faktor risiko utama adalah usia (terutama signifikan untuk sindrom Down), serta paparan radiasi, beberapa logam berat. Perlu diingat bahwa bahkan tanpa faktor risiko, janin mungkin mengalami patologi.
Seperti dapat dilihat dari grafik, ketergantungan nilai risiko pada usia paling signifikan untuk sindrom Down, dan kurang signifikan untuk dua trisomi lainnya:

Skrining risiko sindrom Down
Hingga saat ini, semua wanita hamil, selain tes yang diperlukan, juga disarankan untuk menjalani tes skrining untuk mengidentifikasi tingkat risiko sindrom Down pada kelahiran anak dan kelainan bawaan pada janin. Pemeriksaan paling produktif dilakukan pada 11 minggu + 1 hari atau pada 13 minggu + 6 hari dengan ukuran embrio coccygeal-parietal dari 45 mm sampai 84 mm. Seorang wanita hamil dapat diperiksa dan menggunakan pemindaian ultrasound khusus untuk ini.
Diagnosis yang lebih akurat dibuat dengan menggunakan biopsi vilus korionik dan studi tentang cairan ketuban, yang diambil dengan jarum khusus langsung dari kandung kemih janin. Tetapi setiap wanita harus tahu bahwa metode seperti itu berhubungan dengan risiko komplikasi kehamilan seperti keguguran, infeksi pada janin, perkembangan gangguan pendengaran pada anak, dan masih banyak lagi.
Skrining gabungan penuh pada trimester I-II kehamilan memungkinkan Anda mengidentifikasi malformasi kongenital pada janin. Apa yang termasuk dalam tes ini? Pertama, pemindaian ultrasonografi diperlukan pada usia kehamilan 10-13 minggu. Risiko dihitung dengan menentukan keberadaan tulang hidung, di sepanjang lebar lipatan serviks janin, tempat cairan subkutan terakumulasi pada trimester pertama kehamilan.
Yang kedua, tes darah diambil untuk chorionic gonadotropin pada 10-13 minggu dan untuk alpha-fetoprotein pada 16-18 minggu. Data skrining gabungan diproses menggunakan program komputer khusus. Para ilmuwan telah mengusulkan teknik skrining baru - menggabungkan penilaian hasil yang diperoleh selama penelitian pada trimester pertama dan kedua. Hal ini memungkinkan penilaian yang seragam dari risiko sindrom Down selama kehamilan.
Untuk trimester pertama digunakan hasil penentuan PAPP-A dan pengukuran ketebalan ruang collar, sedangkan untuk trimester kedua digunakan kombinasi AFP, estriol tak terkonjugasi, hCG dan inhibin-A. Penggunaan asesmen integral untuk pemeriksaan skrining memungkinkan, setelah intervensi invasif, untuk mengurangi frekuensi aborsi janin dengan kariotipe normal berdasarkan hasil diagnostik sitogenetik.
Pengujian integral dan biokimia untuk skrining sindrom Down memungkinkan deteksi tambahan untuk lebih banyak kasus kelainan kromosom. Ini membantu mencegah aborsi yang tidak diinginkan akibat amniosentesis atau pengambilan sampel vilus korionik.
Editor ahli: Mochalov Pavel Alexandrovich | d. m. n. dokter
Pendidikan: Institut Medis Moskow. IM Sechenov, spesialisasi - "Pengobatan Umum" pada tahun 1991, pada tahun 1993 "Penyakit Kerja", pada tahun 1996 "Terapi".
Genetika diabetes
Memprediksi diabetes tipe 1 pada kelompok risiko tinggi
T.V. Nikonova, I.I. Dedov, JI.P. Alekseev, M.N. Boldyreva, O. M. Smirnova, I.V. Dubinkin *.
Pusat Penelitian Endokrinologi I (direktur - akademisi RAMS I. I. Dedov) RAMS, I * Pusat Penelitian Negara Bagian "Institut Imunologi" I (direktur - akademisi RAMS R.M. Khaitov) M3 RF, Moskow. saya
Saat ini, terjadi peningkatan kejadian diabetes tipe 1 di seluruh dunia. Hal ini disebabkan oleh sejumlah faktor, termasuk peningkatan harapan hidup pasien diabetes karena peningkatan perawatan diagnostik dan terapeutik, peningkatan kesuburan, dan kemunduran lingkungan. Dimungkinkan untuk mengurangi kejadian diabetes dengan mengambil tindakan pencegahan, memprediksi dan mencegah perkembangan penyakit.
Kecenderungan diabetes tipe 1 ditentukan secara genetik. Kejadian diabetes tipe 1 dikendalikan oleh sejumlah gen: genom insulin pada kromosom 11p15.5 (YOM2), gen pada kromosom \\\\ c (YOM4), 6ts (YOM5). Dari penanda genetik diabetes tipe 1 yang diketahui, gen dari daerah HbA pada kromosom 6p 21.3 (SHOM1) adalah yang paling penting; mereka terkait dengan hingga 40% kecenderungan genetik untuk diabetes tipe 1. Tidak ada wilayah genetik lain yang menentukan risiko pengembangan penyakit yang sebanding dengan HbA.
Risiko tinggi terkena diabetes tipe 1 ditentukan oleh varian alel dari gen HbA: ORB1 * 03, * 04; OOA1 * 0501, * 0301, OOV1 * 0201, * 0302. 95% pasien diabetes tipe 1 memiliki antigen OI * 3 atau 011 * 4, dan 55 hingga 60% memiliki kedua antigen. Alel OOB1 * 0602 jarang terjadi pada diabetes tipe 1 dan dianggap protektif.
Manifestasi klinis diabetes didahului oleh periode laten yang ditandai dengan adanya penanda imunitas seluler pulau; penanda ini dikaitkan dengan kehancuran progresif.
Dengan demikian, prognosis penyakit ini sangat penting bagi anggota keluarga dengan riwayat diabetes tipe 1.
Tujuan dari penelitian ini adalah untuk membentuk kelompok yang berisiko tinggi terkena diabetes tipe 1 pada populasi penduduk Moskow Rusia berdasarkan studi penanda genetik, imunologi dan metabolik diabetes menggunakan pendekatan keluarga.
Bahan dan metode penelitian
Penelitian ini melibatkan 26 keluarga yang salah satu orang tuanya menderita diabetes tipe 1, 5 di antaranya adalah keluarga “inti” (total 101 orang). Jumlah anggota keluarga yang disurvei berkisar antara 3 sampai 10 orang. Ada 13 ayah dengan diabetes tipe 1, dan 13 ibu dengan diabetes tipe 1. Tidak ada keluarga yang kedua orang tuanya akan menderita diabetes tipe 1.
Kami memeriksa 37 keturunan dari pasien diabetes tipe 1 tanpa manifestasi klinis dari penyakit tersebut, dimana 16 adalah perempuan, 21 adalah laki-laki. Usia keturunan yang diperiksa berkisar antara 5 sampai 30 tahun. Distribusi keturunan yang diperiksa menurut umur disajikan dalam tabel. satu.
Tabel 1
Usia anak yang diperiksa (keturunan)
Umur (tahun) Jumlah
Dalam keluarga dengan ibu diabetes, 17 anak (8 perempuan, 9 laki-laki) diperiksa, dalam keluarga dengan ayah diabetes - 20 anak (8 perempuan, 12 laki-laki).
Autoantibodi ke (3-sel (ICA) ditentukan dengan dua cara: 1) pada cryosection pankreas seseorang dari golongan darah I (0) dalam reaksi imunofluoresensi tidak langsung; 2) dalam tes immunoassay "ISLETTEST" oleh "Biomerica". Autoantibodi terhadap insulin (IAA) ditentukan dalam imunoassay ISLETTEST dari Biomerica. Penentuan antibodi terhadap HDC dilakukan dengan menggunakan kit standar "Diaplets anti-GAD" dari "Boehringer Mannheim".
Penentuan C-peptida dilakukan dengan menggunakan kit standar dari Sorrin (Prancis).
Pengetikan HLA pasien diabetes dan anggota keluarganya dilakukan untuk tiga gen: DRB1, DQA1, dan DQB1 dengan metode primer spesifik sekuens menggunakan polymerase chain reaction (PCR).
Isolasi DNA dari limfosit darah tepi dilakukan sesuai dengan metode R. Higuchi H. Erlich (1989) dengan beberapa modifikasi: 0,5 ml darah yang diambil dengan EDTA dicampurkan dalam 1,5 ml tabung microcentrifuge Eppendorf dengan 0,5 ml lysing a larutan terdiri dari sukrosa 0,32 M, 10 mM Tris - HC1 pH 7,5, 5 mM MgC12, 1% Triton X-100, disentrifugasi selama 1 menit pada 10.000 rpm, supernatan dihilangkan, dan sedimen inti sel dicuci 2 kali dengan buffer yang ditunjukkan. Proteolisis selanjutnya dilakukan dalam 50 μl larutan buffer yang mengandung 50 mM KCl, 10 mM Tris-HC1 pH 8,3, 2,5 mM MgCl2, 0,45% NP-40, 0,45% Tween-20 dan 250 μg / ml proteinase K pada suhu 37 ° C selama 20 menit. Proteinase K diinaktivasi dengan pemanasan dalam termostat solid state pada suhu 95 ° C selama 5 menit. Sampel DNA yang diperoleh segera digunakan untuk mengetik atau disimpan pada -20 "C. Konsentrasi DNA, ditentukan oleh
fluoresensi dari Hoechst 33258 pada fluorometer DNA (Hoefer, USA) rata-rata 50-100 μg / ml. Total waktu dari prosedur ekstraksi DNA adalah 30-40 menit.
PCR dilakukan dalam 10 μl campuran reaksi yang mengandung 1 μl sampel DNA dan konsentrasi komponen yang tersisa sebagai berikut: 0,2 mM dari setiap dNTP (dATP, dCTP, dTTP, dan dGTP), 67 mM Tris-HCl pH \u003d 8,8, 2,5 mM MgC12, 50 mM NaCl, 0,1 mg / ml gelatin, 1 mM 2-merkaptoetanol, dan 1 unit DNA polimerase termostabil. Untuk mencegah perubahan konsentrasi komponen campuran reaksi akibat pembentukan kondensat, campuran reaksi ditutup dengan 20 μL minyak mineral (Sigma, USA).
Amplifikasi dilakukan pada siklus termal multichannel MC2 (DNA-Tekhnologiya, Moskow).
Lokus DRB1 diketik dalam dua tahap. Selama putaran pertama, DNA genom diamplifikasi dalam dua tabung berbeda; pada tabung reaksi pertama, sepasang primer digunakan untuk memperkuat semua alel gen DRB1 yang diketahui, pada tabung reaksi ke-2 - sepasang primer yang hanya memperkuat alel yang termasuk dalam kelompok DR3, DR5, DR6, DR8. Dalam kedua kasus, rezim suhu amplifikasi (untuk pengendara sepeda termal MC2 dengan regulasi aktif) adalah sebagai berikut: 1) 94 ° C - 1 menit; 2) 94 ° С - 20 s (7 siklus), 67 ° С - 2 s; 92 "C - 1 s (28 siklus); 65 ° C - 2 detik.
Produk yang dihasilkan diencerkan 10 kali dan digunakan pada putaran ke-2 pada rezim suhu berikut: 92 ° C - 1 s (15 siklus); 64 ° C - 1 s.
Lokus DQA1 diketik dalam 2 tahap. Pada tahap pertama, sepasang primer digunakan yang memperkuat semua spesifisitas lokus DQA1, pada tahap ke-2 - pasangan primer yang memperkuat spesifisitas * 0101, * 0102, * 0103, * 0201, * 0301, * 0401 , * 0501, * 0601 ...
Tahap pertama dilakukan sesuai dengan program: 94 “C - 1 menit; 94 ° C - 20 s (7 siklus), 58 "C - 5 s; 92" C - 1 s, 5 s (28 siklus), 56 "C - 2 s.
Produk amplifikasi dari tahap pertama diencerkan 10 kali dan digunakan pada tahap ke-2: 93 "С - 1 s (12 siklus), 62" С - 2 s.
Pengetikan lokus DQB1 juga dilakukan dalam 2 tahap; pada tanggal 1, sepasang primer digunakan yang memperkuat semua kekhususan lokus DQB1, rezim suhu adalah sebagai berikut: 94 ° С - 1 menit; 94 ° С - 20 s (7 siklus); 67 ° С - 5 s; 93 ° С - 1 s (28 siklus); 65 HP - 2 s.
Pada tahap kedua, kami menggunakan pasangan primer yang memperkuat spesifisitas: * 0201, * 0301, * 0302, * 0303, * 0304, * 0305, * 04, * 0501, * 0502, * 0503, * 0601, * 0602 / 08; produk tahap pertama diencerkan 10 kali dan amplifikasi dilakukan dalam mode berikut: 93 ° С - 1 s. (12 siklus); 67 ° С - 2 s.
Produk amplifikasi diidentifikasi dan distribusi panjangnya dilakukan dalam sinar ultraviolet (310 nm) setelah elektroforesis selama 15 menit baik dalam 10% PAGE, 29: 1 pada tegangan 500 V, atau dalam gel agarosa 3% pada tegangan 300 V (dalam kedua kasus, lari adalah 3-4 cm) dan diwarnai dengan etidium bromida. Intisari plasmid pUC19 dengan enzim restriksi Msp I digunakan sebagai penanda panjang.
Hasil dan pembahasannya
Ditemukan bahwa dalam 26 keluarga dari 26 pasien diabetes tipe 1, 23 orang tua (88,5%) adalah pembawa genotipe HLA yang terkait dengan diabetes tipe 1 DRB1 * 03-DQA1 * 0501 - DQB1 * 0201; DRB1 * 04-DQAl * 0301-DQB 1 * 0302 atau kombinasinya (Tabel 2). Pada 2 pasien, genotipe mengandung alel DQB 1 * 0201, terkait dengan diabetes tipe 1; hanya 1 pasien dari kelompok ini yang memiliki genotipe DRB1 * 01/01, yang mana
Distribusi genotipe di antara orang tua dengan diabetes tipe 1
01? B 1 4/4 2 E1? B 1 - -
Jumlah 23 (88,5%) Jumlah 3
Haplotipe 0I? B1- POAI-POVI ditemukan pada individu yang diperiksa
oіgvі OOAI ROVI
meskipun dalam studi populasi itu tidak terkait dengan diabetes tipe 1, kami tidak membedakan subtipe OK B1 * 04, meskipun polimorfisme lokus ini dapat mempengaruhi risiko pengembangan diabetes tipe 1.
Ketika melakukan genotipe keturunan langsung pasien dengan diabetes tipe 1, terungkap bahwa dari 37 orang, 30 (81%) mewarisi genotipe OJV1 * 03, 011B1 * 04 yang terkait dengan diabetes tipe 1, dan kombinasinya, pada 3 orang di genotipe ada alel yang terkait dengan diabetes tipe 1: pada 1 - OOA 1 * 0501, pada 2 pasien - OOV 1 * 0201. Hanya 4 dari 37 yang diperiksa memiliki genotipe netral dalam kaitannya dengan diabetes tipe 1.
Distribusi genotipe keturunan ditunjukkan pada tabel. 3. Dalam sejumlah "karya dicatat bahwa pasien dengan diabetes tipe 1, ayah lebih cenderung menularkan kecenderungan genetik.
kemungkinan diabetes (khususnya, genotipe HbA-01 * 4) pada anak-anak mereka dibandingkan pada ibu mereka. Namun, sebuah penelitian di Inggris tidak mengkonfirmasi efek signifikan dari jenis kelamin orang tua pada predisposisi yang bergantung pada HbA pada anak-anak. Dalam pekerjaan kami, kami juga tidak dapat mencatat pola serupa dalam transmisi kecenderungan genetik: 94% anak-anak mewarisi genotipe HbA yang terkait dengan diabetes tipe 1 dari ibu yang sakit dan 85% dari ayah yang sakit.
Diabetes mellitus dikenal sebagai penyakit multifaktorial multigenik. Nutrisi - konsumsi protein susu sapi pada masa bayi dan anak usia dini dianggap sebagai faktor lingkungan yang berperan sebagai pemicunya. De-
Tabel 3
Distribusi genotipe di antara anak-anak yang orang tuanya menderita diabetes tipe 1
Genotipe yang terkait dengan diabetes tipe 1 Jumlah karier Genotipe yang tidak terkait dengan diabetes tipe 1 Jumlah karier
0! * B 1 4/4 4 01 * B 1 1/15 1
Jumlah 30 (81%) Jumlah 7 (19%)
mereka yang baru didiagnosis diabetes memiliki peningkatan kadar antibodi terhadap protein susu sapi, β-laktoglobulin, dan serum albumin sapi dibandingkan dengan saudara kandung yang sehat, yang dianggap sebagai faktor risiko independen untuk mengembangkan diabetes.
Pada kelompok anak yang diperiksa, dari 37 orang hanya 4 yang mendapat ASI sampai 1 tahun, 26 orang mendapat ASI sampai 1,5-3 bulan, 4 - sampai 6 bulan, 3 diberi susu formula sejak minggu pertama. hidup. Dari 5 anak dengan antibodi positif terhadap sel-p, 2 disusui hingga 6 bulan, 3 - hingga 1,5 - 3 bulan; kemudian kefir dan campuran susu diperoleh. Dengan demikian, 89% anak yang diperiksa menerima protein susu sapi pada masa bayi dan anak usia dini, yang dapat dianggap sebagai faktor risiko perkembangan diabetes pada individu yang memiliki kecenderungan genetik.
Dalam keluarga yang diperiksa, antibodi sitoplasma, autoantibodi terhadap insulin dan HDA ditentukan pada keturunan yang secara klinis sehat. Dari 37 anak yang diperiksa, 5 anak ternyata positif adanya antibodi terhadap sel-β, sementara kelima adalah pembawa predisposisi genetik terhadap diabetes (Tabel 4). Di 3 di antaranya (8%) antibodi terhadap HDC ditemukan, di 1 - ke ACCO, di 1 - antibodi ke ACCO
Tabel 4
Genotipe anak-anak positif antibodi terhadap (3-sel
Jumlah Genotipe positif untuk antibodi
dan insulin. Jadi, 5,4% anak memiliki antibodi terhadap ACCO, 2 anak dengan antibodi positif terhadap HDC adalah keturunan dari keluarga "inti". Usia anak-anak pada saat deteksi antibodi ditunjukkan pada tabel. 5. Untuk prognosis diabetes, tingkat titer ACTC sangat penting: semakin tinggi titer antibodi, semakin besar kemungkinan berkembangnya diabetes, hal yang sama berlaku untuk antibodi terhadap insulin. Menurut literatur, tingkat antibodi yang tinggi terhadap HDV dikaitkan dengan tingkat perkembangan diabetes yang lebih lambat (10% pada 4 tahun) daripada tingkat yang rendah (50% pada 4 tahun), mungkin karena tingkat antibodi yang tinggi terhadap HDC menunjukkan " lebih disukai ”Aktivasi imunitas humoral dan, pada tingkat yang lebih rendah, aktivasi yang dimediasi oleh sel
Tabel 5
Usia anak yang diperiksa pada saat deteksi antibodi
Usia anak yang diperiksa (tahun) Jumlah anak yang positif antibodi
imunitas (DM tipe 1 terutama disebabkan oleh kerusakan sel-P yang dimediasi oleh sel oleh limfosit T sitotoksik). Kombinasi berbagai antibodi memberikan tingkat prediksi yang paling optimal.
Anak-anak dengan berat badan lahir rendah (kurang dari 2,5 kg) mengalami diabetes lebih awal daripada anak-anak yang lahir dengan berat badan normal. Dari data anamnesis, perhatian tertuju pada fakta bahwa dari 5 anak dengan antibodi positif, 2 lahir dengan berat badan lebih dari 4 kg, 2 - kurang dari 2,9 kg.
Pada keturunan langsung pasien DM tipe 1, ditentukan kadar C-peptida basal, semua indikator ini berada dalam kisaran normal (termasuk anak dengan antibodi positif terhadap sel P), kadar C-peptida terstimulasi tidak dipelajari. .
1. Pasien dengan diabetes tipe 1 pada 88,5% kasus adalah pembawa genotipe OYAVROZ, OOA1 * 0501, BOB1 * 0201, OYV1 * 04, BOA1 * 0301, EOV1 * 0302, atau kombinasinya.
2. Pada anak-anak dari keluarga di mana salah satu orang tuanya sakit diabetes tipe 1, dalam 89% kasus, predisposisi genetik terhadap diabetes terungkap (di hadapan satu orang tua yang sakit), sementara 81% mewarisi genotipe yang sepenuhnya terkait dengan tipe 1 diabetes, yang memungkinkan kita untuk menganggap mereka sebagai kelompok yang berisiko sangat tinggi terkena diabetes.
3. Di antara keturunan langsung dari pasien diabetes tipe 1 dengan kecenderungan genetik, antibodi positif terhadap HDC terdeteksi pada 8% kasus, ATSOK - pada 5,4% kasus. Pada anak-anak ini, studi diagnostik titer antibodi, glycohemoglobin dan studi sekresi insulin diperlukan.
* 1 iterasi
1. Atkinson M.A., McLaren N.K. // N.Engl.J.Med.-l 994 -331. P.l 4281436.
2. Aanstoot H. J., Sigurdsson E., Jaffe M. dkk // Diabetologia-1994-37.
3. Baekkeskov S., Aanstoot H. J., Christgan S. dkk // Alam-1 990-377.
4. Bain S. C., Rowe B. R., Barnett A. H., Todd J. A. // Diabetes-1994-43 (12). Hlm 1432-1468.
5. B / ng / ey P.J., Christie M.R., Bonifacio E., Bonfanti R., Shattock Mw Fonte M.T., Bottazzo C.F. // Diabetes-1 994-43. Hlm 1304-1310.
6. Boehn B.O., Manifras B., Seibler J. dkk // Diabetes-1991-40. Hlm 1435-1439.
7. Chern M. M., Anderson V. E., Barbosa J. // Diabetes-1982-31. P.l 1 151118.
8. Davies J.L., Kawaguchi Y., Bennett S.T. dkk. // Nature-1994-371.
{!LANG-a6bcc2b410fc4e35f6d146c0441bf7bf!}
{!LANG-65998917004537cc958ac70050e374f1!}
{!LANG-650ae5b3a256d2a9a7f8563f2abc9cbd!}
{!LANG-dcda9462b44b0b1b6535df86e0c1b7f4!}
{!LANG-9ce4ad6392615bc469f798093ea8a520!}
{!LANG-d22050faf0f0d85a1e8bce8d429ffc1d!}
{!LANG-2af422f2cc4dcdc435e53fad37748efa!}
{!LANG-0abf872424de1f522edecbf33e18ff98!}
{!LANG-4e74c00c08e25a941b7415490bcc6685!}
{!LANG-3622cff4c1e370b6a4a1aaf5647975e2!}
{!LANG-dd3cca16ff80338af0668d5522e752e6!}
{!LANG-c4bd827febbdb3950b9302fcbd3c71f6!}
{!LANG-54570fb2a01be4f95efc11ef189af5dd!}
{!LANG-d188147ccabf53136420e499cd633cec!}
{!LANG-3c7f6eecace69e51ed7d71f222f5cbca!}
{!LANG-400f59a767531a2ac9235b9161095a30!}
{!LANG-e0d7c3554f680095712b41f5b3f8475e!}
{!LANG-aacd6c4a4424cd46e9f36b355cbfeedd!}
{!LANG-5f08506bae6b3b9dd5b2fc59eb6e4200!}
{!LANG-a52cc00d4c77149e9169c374648dd678!}
{!LANG-d58660fdb06386d6ed868cfe7a6864d6!}
{!LANG-7a19467419e231f834be8d22bac4563a!}
{!LANG-4c611553bae2e716e952e3638542321c!}
{!LANG-2b6ee7b8f9d763001bdf0a793e276b59!}
{!LANG-77b36333798bddd1dba45783cb1fb3e2!}
{!LANG-da391490eec891cbac4c09df9a28c4f2!}
{!LANG-d2d1d72479221da6a06f86074338bc94!}
{!LANG-5e47e51b747da11b08dd19516f2db0a8!}
{!LANG-db17fc63d8b6d6612e095f1fe8199148!}




